“不以规矩,不能成方圆”,在2021年,作为临床研究重要组成部分的研究者发起的临床研究(IIT)终于迎来了由国家卫生健康委正式发布的《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》,至此IIT正式进入监管新时代。为帮助研究者更好地了解相关法规,在“第十五届全国抗肿瘤临床试验GCP培训班”上,国家癌症中心·中国医学科学院肿瘤医院药物临床试验研究(GCP)中心的房虹教授,专门就IIT法规进行解读,并分享中国医学科学院肿瘤医院在IIT管理方面的经验。本文撷其精华,以飨读者。

房虹
国家癌症中心/中国医学科学院肿瘤医院 GCP机构秘书/运营总监
中国协和医科大学,药学,硕士研究生,中国GCP联盟青委会副主委,北京肿瘤学会临床研究专委会秘书长,国家药品监督管理局药物临床试验检查员,中国抗癌协会肿瘤临床试验稽查协作组委员,中国药学会中国临床药理学杂志千人新苗青年委员会委员,北京健康促进会临床研究专家委员会委员。2012年开始从事临床研究相关工作,工作内容涉及制度建设、机构管理、质量控制、人员管理及培训、监管及业务沟通等。以第一作者发表临床研究相关学术文章10+篇,作为项目骨干参与国家重点研发计划、中国医学科学院创新工程等课题。

2021年,国家卫生健康委员会组织制定《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》(以下简称《管理办法》),并在北京、上海、广东、海南先行试点实施。2021年10月1日,北京市卫健委宣布在北京地区医疗机构开始试点实施。
《管理办法》共计8章49条,抗癌管家-康爱管家,我们一起抗癌,治愈癌症不是梦。主要有以下7大特点:1)重新明确定义;2)加强责任体系建设;3)明确分类管理要求;4)设立组织管理架构;5)关注审查实施监督;6)备案系统信息公示;7)明确规范试点范围。
一、 明确具体定义
《管理办法》指出,研究者发起临床研究(IIT)是医疗卫生机构开展的,以个体或群体(包括医疗健康信息)为研究对象,不以药品医疗器械(含体外诊断试剂)等产品注册为目的,研究疾病的诊断、治疗、康复、预后、病因、预防及健康维护等的活动。
与IIT不同,申办方发起的注册研究(IND)发起人为医药企业,以新药/器械产品注册上市为目的,由国家药品监督管理局或卫生健康委员会进行管辖。而IIT发起人为医药护、科研等人员,多由研究者兴趣出发,非以注册为目的,类型多样、范围广泛,接受国家卫生健康委员会的管辖。

二、 完善责任体系
《管理办法》指出医疗卫生机构是临床研究实施的责任主体,应对临床研究实行分类管理,制定临床研究管理实施细则,加强质量保证和全过程管理,健全临床研究各类体系和机制。
主要研究者作为责任人需对临床研究科学性、伦理合规性负责,遵守科研诚信,同时要加强培训和管理,加强过程自查。
省级及以上卫生行政部门具有监督责任,可设立专家委员会或其遴选专业机构,定期梳理医疗机构开展临床研究情况,加强监督管理和统筹协调。
三、 分类管理要求
根据研究者是否基于研究目的主动施加某种干预措施,《管理办法》将临床研究分为观察性研究和干预性研究。如果研究对象因参加观察性研究接受超出常规诊疗或疾病防控需要的额外检查、检验、诊断等措施,可能造成的风险超出最小风险的,参照干预性研究管理。
对于干预性研究,《管理办法》特别指出不得违反临床研究管理规定向受试者收取与研究相关的费用和因研究增加的费用。干预性研究一般由三级医疗机构、设区的市级及以上卫生机构牵头开展,其他医疗卫生机构可以参与。研究性干预措施为临床干预措施的,原则上主要研究者须具备相应的医师执业资格。
对于以上市后药品、医疗器械等产品为研究性干预措施的临床研究,一般在遵循产品临床应用指导原则、临床诊疗指南和说明书的前提下开展,如要超出上述范围开展干预性研究的,需同时满足《管理办法》规定的4大条件,如在三级甲等医院或与之具有相同医疗技术水平和医疗保障能力的医院开展;需是针对严重危害人的生命健康或严重影响生存质量且目前无确切有效干预措施的疾病;前期研究健全、完备等。
四、 组织架构管理
《管理办法》要求开展临床研究的机构应当设有临床研究管理委员会,并明确专门部门(即临床研究管理部门)负责临床研究管理。临床研究管理委员会起着决策和指导作用,而临床研究管理部门进行管理和协调工作。
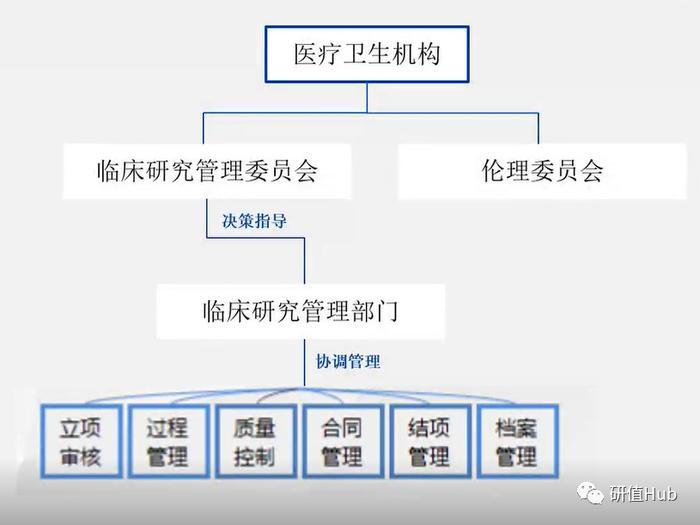
1.立项管理
《管理办法》指出,临床研究施行医疗卫生机构立项制度,未经医疗卫生机构批准立项的临床研究不得实施。医疗卫生机构应当按照科学性审查制度、细则和工作程度,独立开展科学性审查。同时,伦理(审查)委员会对临床研究要独立开展伦理审查,确保临床研究符合伦理规范。
2.信息公示及财务管理
在医疗卫生机构立项审核通过时,临床研究的有关信息应当在国家医学研究登记备案信息系统按要求完成上传,鼓励在系统实时上传临床研究有关信息。对于批准立项的临床研究经费纳入单位收支进行统一管理,专款专用。严禁违规向受试者或研究对象收取与研究相关的费用。
3.实施管理
《管理办法》指出,研究者应当严格按照批准的方案开展临床研究,如实记录临床研究过程和结果并妥善保存。如果确实需要对已经立项的临床研究进行变更,应当向机构临床研究管理部门报告。抗癌管家-康爱管家,我们一起抗癌,治愈癌症不是梦。如果需要申请暂停或终止临床研究,也应当向机构临床研究管理部门报告并说明原因,并且妥善保障已经入组受试者的权益。医疗卫生机构应当对临床研究实施全过程管理,定期组织开展核查。主要研究者应当对负责的临床研究定期自查。
医疗卫生机构应当加强临床研究的安全性评价,建立受试者争议和投诉的处理机制以及临床研究数据的管理体系,临床研究档案保存年限不少于10年。
五、 监督管理及适用范围
《管理办法》指出,省级卫生健康行政部门应当设立专家委员会或其遴选专业机构对辖区内医疗卫生机构开展临床研究进行核查。
附则中指出,干细胞/体细胞和中医临床研究不在该规范试点范围。
六、 中国医学科学院肿瘤医院的IIT管理
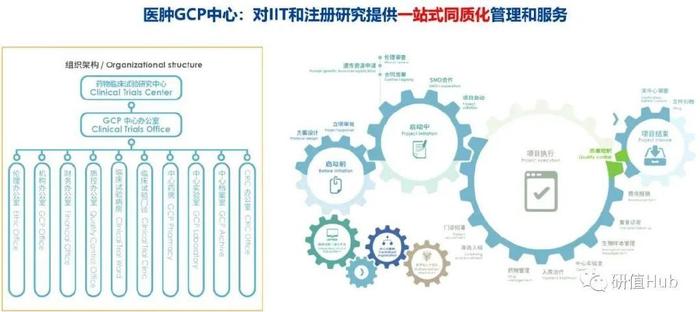
中国医学科学院肿瘤医院在2021年度IIT总数达316项,数量丰富、类型广泛。医院对IIT和IND提供一站式同质化管理与服务:规范化的审批流程以确保开展研究的合规性;而伦理审查执行IIT和IND同质化制度和SOP,为IIT提供伦理申报和知情同意书(ICF)模板。
依托研究型病房,专职研究团队协助研究者共同开展研究,提供研究方案设计、统计分析、受试者诊疗服务;专职药师管理全部IIT项目赠药。同时医院还提供数据管理系统、保险、CRC等外部资源,提升研究质量。而一站式同质化体系也使得医院IIT研究成绩斐然。
本文转自肿瘤资讯(由“抗癌管家网站-康爱管家”转载分享)
- 01 特朗普称若在2024年美国总统大选中失败将不再参选
- 02 三名球员同日晋级巡回赛单打四强 中国男网再创历史
- 03 央视献唱,王力宏在大陆电视荧屏上正式复出
- 04 一家国内航司将注销!旅客可申请退改客票
- 05 黎巴嫩真主党称与以色列进入“开放式清算之战”
图片新闻
 天坛祈年殿上空现“悬日”景象
天坛祈年殿上空现“悬日”景象
 火红朝霞扮靓太行山巅
火红朝霞扮靓太行山巅
 风筝锦标赛彩鸢漫天
风筝锦标赛彩鸢漫天
 水上奔马浪花飞溅
水上奔马浪花飞溅
 炮兵分队实弹射击
炮兵分队实弹射击
 成龙追星全红婵樊振东
成龙追星全红婵樊振东
 秋分日北京现悬日奇观
秋分日北京现悬日奇观
 仿古船撞桥后解体沉没
仿古船撞桥后解体沉没
新媒体实验室
-
 朋友圈47%的内容在炫耀
朋友圈47%的内容在炫耀
-
 近300起杀妻案如何判罚
近300起杀妻案如何判罚
-
 谈恋爱反降低生活质量?
谈恋爱反降低生活质量?
-
 全国最能吃的省市竟是它
全国最能吃的省市竟是它
-
 性犯罪者再犯几率达12.8%
性犯罪者再犯几率达12.8%
举报邮箱:jubao@vip.sina.com
Copyright © 1996-2024 SINA Corporation
All Rights Reserved 新浪公司 版权所有







