
2022年8月26日,欧洲心脏病学会年会(ESC 2022)正式发布《2022 ESC非心脏手术患者心血管评估和管理指南》。新版指南距离上一版本的发布已间隔8年之久,对比2014版指南,新版指南的内容更为翔实,对非心脏手术围手术期心血管常见问题的重点决策做出了更详细的指引,能够更好地指导临床实践。

扫描二维码
下载保存指南PDF中文全译版!

第1章 目录
(一)
第2章 前言
第3章 临床风险评估
第4章 术前评估工具
第5章 降低总体风险的策略
第6章 特殊疾病
6.1 冠脉动脉疾病
6.2 慢性心力衰竭
6.3 瓣膜性心脏病
6.4 已知存在或新诊断的心律失常
6.5 成人先天性心脏病
6.6 心包疾病
6.7 肺部疾病和肺动脉高压
6.8 高血压
6.9 外周动脉疾病
6.10 脑血管疾病
6.11 肾脏疾病
6.12 肥胖
6.13 糖尿病
6.14 癌症
6.15 2019冠状病毒病
第7章 降围手术期监测和麻醉
7.1 围术期监护
7.2 麻醉
7.3 局部区域技术
7.4 围术期目标导向的血流动力学治疗
7.5 术后管理
第8章 围手术期心血管并发症
8.1 围手术期心肌梗死/损伤
8.2 自发性心肌梗死(第2天后)
8.3 Takotsubo综合征
8.4 急性心力衰竭
8.5 静脉血栓栓塞
8.6 心房颤动及其他相关心律失常
8.7 围手术期卒中
第9章 关键信息
第10章 有待更多证据支持
第11章 性别差异
第12章 指南中“应该做”和“不应该做”的建议
第13章 质控指标
第14章 中心示意图
第6章 特殊疾病
合并心血管疾病患者在行非心脏手术治疗会增加心血管事件发生风险。心血管并发症的发生风险和围手术期的治疗取决于心血管疾病的类型。
6.1 冠脉动脉疾病
6.1.1 合并冠脉疾病的风险
合并冠脉疾病的围手术期风险依赖于基础的心血管疾病、手术的类型及非心脏手术的紧急程度。老年患者的风险高于年轻患者。近期出现急性冠脉综合征(ACS)患者的风险高于慢性冠脉综合征(CCS)患者。
6.1.2 术前风险的评估和治疗
对于慢性冠脉综合征患者诊断和术前评估在第4章节中被列出。冠脉CT(CCTA)和冠脉造影(ICA)的评估价值在第4.5.3.1和4.5.3.2中已经被讨论。
对于需行紧急NCS的患者,手术不能耽搁、需尽快进行,评估手术前风险时间应缩短。
对于合并急性冠脉综合征(ACS)又需行择期NCS的患者,ACS的治疗仍应遵循非手术情况下的ACS指南来进行98,171。在这种情况下,NCS前处理罪犯血管病变是合理的。另外手术时机的选择和围手术期管理策略(例如手术的方式、麻醉、药物治疗和围手术期监测)应在考虑的范围内。
对于已知冠心病患者,推荐在NCS术前有足够的时间收集患者的临床资料包括既往有创的和无创诊断性检查、冠心病的干预治疗,从而寻找最佳的行NCS时机。
6.1.3 血运重建策略
冠脉血运重建的指征取决于临床冠心病的分类(ACS vs. CCS),紧急程度和NCS的心脏风险。通常在ACS患者中,常规血运重建可以改善预后。对CCS患者的治疗决策应该个体化,对于合并有意义的心肌缺血病变或反复发作的症状,应尽早行冠脉血运重建治疗,对于无反复发作的冠心病症状患者,可以合理选择药物治疗。
6.1.3.1 慢性冠脉综合征(CCS)
对于CCS患者而言,NCS前进行血运重建可以预防因围手术期心肌缺血导致的急性心肌梗死、血流动力学不稳定或者心律失常。数据显示致死性围手术期心肌梗死患者中,通常超过2/3患者有显著的左主干病变或者三支血管病变397。一项回顾性的冠脉搭桥注册研究(CASS)显示冠脉搭桥术(CABG)可以显著降低围手术期死亡和急性心肌梗死发生概率,特别在合并三支血管病变且左室射血分数减低患者中398。在CARP研究中,510例CCS患者被随机分为最佳药物治疗组和冠脉血运重建组(外科或PCI)399。与内科治疗组相比,接收冠脉血运重建患者在30天的急性心肌梗死发生率(8.4% vs. 8.4%)和2.7年死亡率(22% vs. 23%)方面无显著差别。值得一提的是,这项研究除外了有意义的左主干病变,其中1/3患者合并三支血管病变399。在另一项随机研究中,426例无明显症状的冠心病患者拟行颈动脉内膜剥脱术(CEA),随机分为术前常规冠脉造影组和无冠脉造影组,在30天随访中,两组之间在全因死亡率、急性心肌梗死和卒中方面未见明显差别172。在对3949例患者的meta分析中提示非心脏手术术前常规预防性冠脉血运重建并未带来临床获益400。对4414例行关节置换术患者的回顾性分析显示,在冠心病患者中,不论术前是否行血运重建治疗,发生不良心血管事件的风险增加,然而当血运重建术和行关节置管术的间隔时间超过2年的时间后,发生不良心血管事件的风险降低401。尽管证据提示在CCS患者中常规造影血运重建治疗未带来临床获益,但是在合并显著缺血患者(如左主干病变或者反复发作症状的)临床决策的制定需要结合患者病情,评估风险-获益比,选择最优的策略。在ISCHEMIA研究中,5179例稳定性冠心病患者分为合并中度或重度心肌缺血进行血运重建组或者单纯药物治疗组,在主要终点如死亡、急性心肌梗死方面二者无显著差别402。有趣的是这部分患者不包括严重的左主干病变,因为这些患者在随机化分组的术前冠脉CTA检查已排除在外。目前术前冠脉CTA检查能否作为筛选稳定性CAD患者或者中重度心肌缺血患者,这部分患者能否从早期的有创检查中获益尚不清楚。在一项大型的纳入9016例CCS患者的造影注册性研究中,其中高危冠脉解剖病变(有≥70%三支血管病变或者左主干病变≥50%),与保守药物治疗相比,行血运重建(包括PCI或者CABG)可以带来显著的获益(HR,0.62;95% CI, 0.58~0.66,P<0.001)403。
2018 ESC/EACTS心脏血运重建指南和2019年ESC关于CCS的诊断和管理指南中对于这部分人群的CCS患者推荐如下,只要NCS能延迟足够长的时间,直到可以安全停止双联抗血小板药物治疗,则可在NCS术前行血运重建治疗146,404。同样,选择PCI或者冠脉搭桥术应该遵循上述指南提供的基本条例268,404。指南鼓励采用腔内影像学手段计划或者优化PCI方案 405,406。
6.1.3.2 ACS
目前尚无临床研究探讨ACS同时拟行NCS患者的血运重建策略。对于高危或极高危的患者应当按照2020年ESC指南中处理非ST段抬高型急性冠脉综合征(NSTE-ACS)的方案处理98,采取早期(<24h)或快速(<2h)有创治疗策略。在低危组中,治疗决策的选择等同于CCS患者。
在HIP-ATTACk研究的亚组分析中显示,在肌钙蛋白升高的患者中,早期干预治疗(从诊断到治疗<6h较标准治疗相比可以降低死亡风险(HR 0.38,95% CI 0.21-0.66)57。
血运重建方式的选择应该取决于冠脉解剖特点及冠脉复杂的程度及是否存在糖尿病268,404。当选择PCI时,应选用药物洗脱支架407。危及生命的临床情况、需要行紧急NCS时,同时又合并有血运重建指征的ST段抬高型ACS(ACS-STEMI)的患者,可考虑采用球囊行PTCA术,并且延迟支架植入408,409。图12展示了择期行NCS的冠心病患者诊断和处理流程。
图12:急性或慢性综合征患者准备行非心脏手术的处理策略
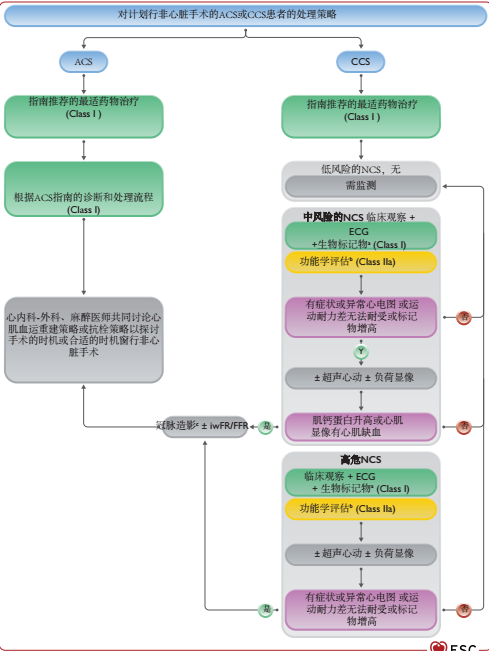
推荐表19 对于已知有冠心病患者行NCS和血运重建的时机选择

6.2 慢性心力衰竭
6.2.1 慢性心力衰竭风险
心力衰竭是各样不同外科手术术后死亡的危险因素之一410-412。对于拟行NCS患者,心衰是术后不良事件预后的独立预测因子411,413。
与心力衰竭相关的术后死亡风险取决于左室收缩功能是保留或减低的,血流动力学是否代偿,和心衰的症状414,415。在行NCS患者中,有出现急性失代偿心力衰竭风险,包括由液体滞留所致的迅速出现或恶化的心衰症状及体征及伴随情况412。
围手术期急性或者慢性心力衰竭患者可增加NCS患者死亡风险。在发表的21560996例行NCS的患者中,住院期间诊断为心力衰竭患者较无心力衰竭患者相比,院内全因死亡率更高(4.8% vs. 0.78%,OR 2.15, 95% CI 2.09-2.22)416。在慢性心力衰竭中,慢性心力衰竭急性加重较代偿的心力衰竭患者围手术期死亡风险更高。在一项大规模队列研究中提示,行急诊手术的心力衰竭患者90天大致的死亡率是2.0%,而非心力衰竭中的死亡率约0.4%417。30天围手术期并发症在心力衰竭组和非心力衰竭组分别为5.7%和2.7%。值得一提的是,随着收缩功能的恶化,死亡风险进行性提高。目前对于失代偿的心力衰竭患者不推荐行择期NCS。
在4.4章节中讨论了术前心脏超声和BNP水平评估左室功能的价值。术前应具备6个月之内超声心动结果,或者紧急NCS术前应具备超声心动的结果。
6.2.2 术前和术后的管理策略
择期手术术前应对心衰患者进行优化指南指导的药物治疗,以降低心衰急性发作和死亡的风险412。另外需关注出入量的平衡,因为围手术期常常需要大量输液。对于中高风险的心衰患者中,通常需要有创动脉压力监测以获得血氧饱和度和代谢的参数。另外从动态压力监护的波形中得出的参数(心排出量、每搏输出量和动脉血压的变异)有利于心衰目标指导的治疗策略。其它的有创检测如右心导管和经食道心脏超声可以在个体化的患者中考虑应用(7.1章节)。
在整个围手术期,基础的药物治疗应按照指南推荐的来进行(5.2章节)。在术后急性失代偿的心力衰竭患者推荐行ECG检查、测量心肌损伤的指标(cTnI/cTnT)和完善超声心动检查以制定最佳治疗策略。
在行NCS的患者中,对于植入心脏电子设备的管理在6.4.5章节中讨论。在植入心脏再同步治疗器械的患者中,应保证该器械的正常工作以维持血流动力学稳定。
6.2.3 肥厚梗阻性心肌病
肥厚梗阻性心肌病(HOCM)患者在行NCS时并发症的风险增加,需要额外注意418。推荐术前行超声心动检查评估心脏肥厚的程度、梗阻程度及左室舒张功能419。应该避免术前长时间的空腹及脱水,这对于维持每搏输出量及降低梗阻风险至关重要的。另外围手术期需要避免使用可导致血管扩张的麻醉药物及保证液体的平衡。心率应该控制比较低的水平(60-65次/分),避免房颤发生风险。在围手术期减轻左室流出道梗阻的药物应该继续使用。
6.2.4 有左室辅助装置患者拟行非心脏手术
左室辅助装置(VADs)在终末期心力衰竭到心脏移植的桥接治疗或者在长期目标治疗方面起到重要作用。随着接受VAD作为心衰终末期治疗的患者数量增多420,421,这部分患者需要行NCS的数量也逐年增多。NCS应该在有VADs团队的外科中心开展(表11)。
表11 接受非心脏手术的有左室辅助装置的围手术期策略选择

推荐表20 对于已知心力衰竭患者行非心脏手术处理策略

6.3 瓣膜性心脏病
6.3.1 瓣膜性心脏病患者的风险
瓣膜性心脏病增加NCS患者围术期心血管并发症的风险。风险大小的程度取决于瓣膜性心脏病的严重程度以及NCS的类型。梗阻性瓣膜病患者的风险尤为升高,如症状性AS或MS,在围手术期容量变化和心律失常均可能导致呼吸困难。424
6.3.2 术前管理策略及风险降低策略
所有计划行择期中高危NCS的确诊或疑似VHD的患者,均应进行临床及超声评估。>1年前诊断为轻度至中度VHD的患者应重新进行临床和超声心动图评估。对严重VHD的患者进行心脏团队的评估可能会有获益。应对瓣膜介入和NCS相关并发症的风险均加以评估,并与患者和外科手术团队进行沟通。
6.3.2.1 主动脉瓣狭窄
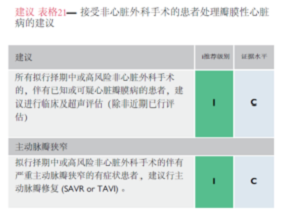
NCS围手术期与主动脉瓣狭窄(AS)相关的风险取决于是否有临床症状、狭窄的严重程度,和并存的心脏疾病。(如冠状动脉性心脏病,二尖瓣关闭不全,LVEF减低)。严重的AS症状是术后发生心肌梗死和心力衰竭重要的危险因素,也是术后30天及长期死亡率的预测因素。425,426对于接受中高风险的NCS患者来说,精细的围术期管理是至关重要的。尽管麻醉、手术技术及术后管理方面最新前沿研究过分强调了AS在接受低危NCS患者中的危险性。对于进行中高危NCS的AS患者而言,接受主动脉瓣置换术(AVR)可减低患者术后30天死亡率和发病率,缩短住院时间。425,42 然而,拟行的NCS与AVR的时机如何选择,应根据患者基础危险因素以及NCS相关的风险评估权衡后进行。而选择外科主动脉瓣置换术(SAVR)或是经导管主动脉瓣置入术(TAVI)应遵照2021 ESC/EACTS瓣膜性心脏病的管理指南245和患者知情偏好共同决定。(表13)
对于行择期NCS的症状严重的AS患者,建议在NCS行主动脉瓣干预(SAVR或TAVI)。对于行限期NCS的患者,TAVI是更合理的选择。427对于难以进行TAVI或SAVR手术,而需进行限期NCS的症状严重的主动脉瓣狭窄患者,可考虑NCS术前行主动脉球囊成形术(BAV)作为桥接手段。无症状的严重主动脉瓣狭窄且LVEF值正常的患者,可安全进行无大体液容量变化的低-中风险NCS。245,248
6.3.2.2 二尖瓣狭窄 (MS)
超声心动图上显示轻度MS(瓣口面积>1.5cm²),中-重度无症状的MS(瓣口面积≤1.5cm²)以及肺动脉收缩压(SPAP)<50mmHg的患者可以耐受风险相对较低的NCS。429由于跨瓣压差具有血流敏感性,因此NCS期间的心动过速及液体超负荷可引起肺水肿。因此,避免应用舒张动脉血管的药物,监测围术期心房颤动的发生具有重要意义。高血栓风险患者的抗凝管理在5.3.2章节讨论。中-重度MS且SPAP>50mmHg的无症状患者,以及有症状患者的围术期心血管事件风险增加。在这种情况下,高风险的NCS前可考虑行经皮二尖瓣闭式分离术(PMC)。此外,应配备一个多学科团队管理适合行PMC的中重度二尖瓣狭窄患者,只有患者情况允许才可能进行NCS。假如瓣膜形态不适合PMC,无症状的严重二尖瓣狭窄的患者可以在术前术后严密的血流动力学监测下进行中危的急诊NCS。
6.3.2.3 主动脉瓣反流
对于轻-中度主动脉瓣反流(AR)的患者,NCS并不增加额外风险。具有瓣膜干预指征的严重AR患者,进行中-高危的NCS前需治疗瓣膜疾病。(表格21及2021 ESC/EACTS瓣膜性心脏病的管理指南)。245
6.3.2.4 二尖瓣反流
严重的有症状的二尖瓣反流(MR)患者,需对瓣膜疾病的类型(原发或继发)以及左室功能进行评估。继发的MR,特别是由缺血引起,其NCS过程中发生心血管并发症的风险升高。430符合干预指征的严重MR患者,在进行中或高危NCS前,应先对瓣膜疾病进行治疗。对于有症状的中重度继发MR患者,如果符合COAPT标准,可在NCS前行经导管缘对缘治疗。(图14)245,431对于严重的原发性MR伴左室功能减低,无论其是否有症状,均建议性瓣膜修复治疗(表格21及2021 ESC/EACTS瓣膜性心脏病的管理指南)。
对于LVEF降低并伴有AR或MR的患者,特别是在进行高危手术时,术中血流动力学监测、心率控制和严谨的液体平衡对于避免血流动力学恶化至关重要。
6.3.2.5 人工瓣膜的患者
既往接受过手术矫正并装有人工瓣膜的瓣膜病患者,若无瓣膜功能障碍的证据,可以接受NCS。在目前的临床实践中,面临的主要问题是围手术期抗凝方案的调整,详见章节5.3。
6.3.2.6 感染性心内膜炎的预防
NCS的患者对感染性心内膜炎的预防与2015年ESC感染性心内膜炎管理指南一致。432



6.4 已知存在或新诊断的心律失常
心律失常给接受NCS的患者带来极大负担,导致这部分病人过高的患病率和死亡率。433,434
6.4.1 围术期管理——一般处理
心律失常,即室上性心动过速(SVT)和室性心动过速(VT),可能还合并急性外科疾病。除非心律失常危及生命,否则不应推迟紧急外科手术。所有接受择期手术且合并已知心律失常的患者,术前应完成12导联心电图以及心脏专科检查。预防心律失常的潜在诱发因素至关重要:术前、术中和术后应避免电解质和酸碱平衡紊乱、心肌缺血(可能因过度失血和贫血引起)以及导致自主神经功能亢进的大量体液转移。收缩性心衰患者应接受最佳药物治疗,该治疗可降低总死亡率和心源性猝死(SCD)的风险。435 已经服用抗心律失常药物(AADs)的患者,一般不应停药。恶性心律失常高危患者在围手术期应进行连续的心电监测,尤其应重点关注在NCS期间停用植入式心律转复除颤器(ICD)的患者。
6.4.2 室上性心动过速
室上性心律失常通常不会导致手术延期。在少数情况下,心电图有预激表现且房颤波经旁路快速前传的患者具有心脏性猝死(SCD)的风险,如果外科手术并非紧急,则可能需要消融治疗。
室上性早搏通常不需要治疗,但强烈建议识别并纠正潜在的诱发因素(电解质和酸碱平衡紊乱、容量超负荷等)。围手术期发生的室上速通常对迷走神经刺激反应良好,如果刺激不成功则可以应用腺苷。如果室上速持续发作或反复发作,静脉应用β受体阻滞剂、维拉帕米或地尔硫卓可用于转复或减慢房室传导。在血流动力学不稳定等罕见情况下,应立即进行电复律。如果需要针对室上速复发进行预防性治疗,则可以使用β阻滞剂或非二氢吡啶类钙离子拮抗剂(维拉帕米,地尔硫卓),如果以上药物无效,可以考虑氟卡尼/普罗帕酮或胺碘酮。在罕见情况下,室上速经治疗后仍反复发作或持续不断,此时应考虑对接受高风险非急诊手术患者进行消融治疗。最近发表的一项随机对照试验结果证实,射频消融治疗持续发作的房室结折返性心动过速的效果优于抗心律失常药物(AADs)。大量注册研究和荟萃分析已经证实了射频消融治疗预激综合征和其他室上速的有效性和安全性,单次手术成功率可超过90%。
6.4.3 心房颤动/心房扑动
大多数房颤患者接受终身口服抗凝药(OAC)治疗以预防卒中和体循环栓塞99,口服抗凝治疗在围手术期的管理策略取决于手术类型(详见5.3.2节)。99,240房颤有时可表现为无症状442,可能在入院手术前才首次发现,也可能在术前发现。对新诊断的房颤的初始管理包括预防血栓栓塞和症状控制,不应延误心脏病专家会诊。99对于新诊断的房颤患者,需要口服抗凝药治疗以预防脑卒中,术前抗凝药物的选择取决于手术类型(详见5.3.2节)。最佳心率控制(即静息心率110 bpm)99对所有房颤患者都是必须的,但术前节律控制(即实现和维持窦性心律)可能只在达到最佳心率控制但症状仍存在时才考虑。
使用β受体阻滞剂或非二氢吡啶类钙离子拮抗剂(维拉帕米,地尔硫卓)可以实现心室率控制。胺碘酮可作为心衰患者的一线治疗,而地高辛通常在手术等高肾上腺素水平时无效。有症状的新发房颤可尝试使用氟卡尼或普罗帕酮进行药物转复;在没有显著的左室肥厚、左室收缩功能障碍或缺血性心脏病的患者中,使用氟卡尼或普罗帕酮可使50%的患者迅速(3-5小时)且安全的恢复窦性心律。静脉注射胺碘酮效果有限且具有延迟作用,能在12 h内减慢心率;静脉应用维那卡兰是最快速的转复药物,可应用于包括轻度心衰和/或缺血性心脏病的患者。99,443多非利特在欧洲未被使用,而伊布利特可以有效地将心房扑动转复为窦性心律。99,444对于血流动力学不稳定的房颤患者,需要紧急电复律(最常用直流电复律),99 或者当患者的临床状态允许时,可尝试静脉使用抗心律失常药物进行药物复律。后续的口服抗凝药治疗应尽快启动以预防血栓栓塞事件。关于手术后房颤的讨论见第8.6节。
心房扑动治疗遵循与房颤相同的口服抗凝治疗原则。心率控制通常是心房扑动患者的初始治疗方法,然而减慢房室传导的药物(地高辛、β受体阻滞剂或非二氢吡啶钙离子拮抗剂)通常不如治疗房颤时有效。对于合并快速心室率的患者,经常需要进行电复律。445–448 胺碘酮是控制心室率的一种选择,特别是应用于心衰或重症患者。449多非利特和伊布利特对心房扑动转为窦性心律有效,而IA类和IC类药物和胺碘酮因疗效较差不应使用。450–453
6.4.4 室性心律失常
室性早搏和非持续性室速在普通人群和接受NCS的患者中很常见。一些特殊的临床特征被认为是增加室性早搏发生率的预测因素。然而最近的研究表明,在心脏正常的患者中,这两种心律失常依旧可能与不良结果相关,特别是发作频繁的情况(例如10-20%)。455–459 在心脏病患者中,室性早搏和非持续性室速对预后的影响取决于对心脏损害的类型和程度。460-466接受紧急NCS的患者,除非发作频繁且有症状,否则不需要治疗。如果存在血流动力学障碍,建议提高β受体阻滞剂的滴度;如果β受体阻滞剂不能耐受或有禁忌症,应考虑使用胺碘酮(300mg静脉滴注)。367对于等待择期NCS的患者,特别是发作频繁、病情复杂的非持续性VT、有症状或有SCD家族史的患者,需要进一步诊断以排除明显的心脏疾病。
多形室速和室颤可由缺血、电解质失衡引起,也可能是原发性心电性疾病的表现,如长QT或Brugada综合征。单形室速常与心肌疤痕有关。因此,等待外科手术的患者围手术期VT或VF应进行心脏检查,以排除存在严重心室功能障碍(见4.5.1节)、需要紧急血运重建的冠心病(见6.1节)以及其他可能导致心律失常的原因(原发性心电性疾病,电解质平衡紊乱)。无明显结构性或心电性疾病患者的单形室速(如流出道起源的特发性室速)与良好预后相关,可不予治疗,如果有症状,可使用β受体阻滞剂、维拉帕米或钠通道阻滞剂治疗。对于血流动力学紊乱的室速患者,应进行电复律(如果有意识,应先静脉镇静),室颤应立即除颤终止。急性缺血时反复发作的VT和VF可以用β受体阻滞剂和胺碘酮有效治疗,冠心病心肌血运重建也具有有效治疗的作用。468将β受体阻滞剂提高到最大耐受剂量可防止心律失常反复发作。469
对于血流动力学稳定的持续性VT,心脏转复应作为一线治疗;对于没有心衰或心肌缺血的患者,可考虑静脉注射普鲁卡因胺或弗卡因。在没有这些药物的情况下,可以使用胺碘酮静脉注射。在特定病例中,瘢痕心肌患者尽管接受了最佳治疗,但单形VT反复发作且无可逆性原因时,但如果NCS可以延期,那么术前应进行有创电生理检查和消融。在广泛的心内膜室速消融后,口服抗凝治疗一段时间可能是合理的。表12是对室上速或室速患者诊断和治疗途径的总结。
表12 心律失常患者的围手术期管理
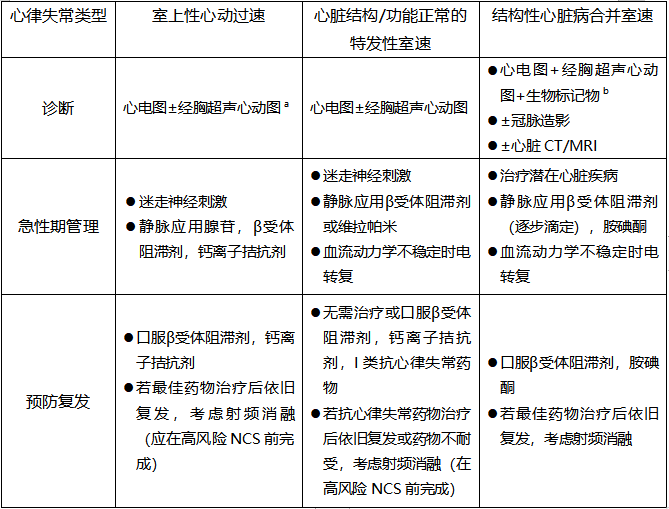
a 在高风险外科手术前完成
b 高敏肌钙蛋白T/I,和/或心房脑钠肽/氨基末端心房脑钠肽前体
6.4.5 缓慢性心律失常
围手术期临时心脏起搏植入应限于接受紧急NCS患者,当心动过缓在静脉注射变时类药物后仍旧出现血流动力学紊乱或诱发室速时,考虑植入临时起搏器。接受择期NCS的患者,如果可能的话手术应推迟,如果满足起搏适应症,应植入永久性起搏器。无症状的双束支阻滞伴或不伴一度房室传导阻滞,通常不是预防性起搏的适应症,应用促变时类药物(阿托品、异丙肾上腺素、肾上腺素,或在β受体阻滞剂/CCB类过量情况下交替使用氨茶碱、多巴胺或胰高血糖素)通常是有效的。双束支传导阻滞或H-V间期延长的患者发生完全传导阻滞的风险较高。482,483 对于双束支传导阻滞的患者,在进行NCS期间,需要时刻备用紧急经皮起搏设备和能够进行此类操作的人员,或者也可以植入永久性心脏起搏器。
6.4.6 心脏植入式电子设备(CIED)患者的管理
CIED患者在适当的围手术期设备管理下可以接受NCS。在没有任何故障的情况下,起搏器患者在术前12个月内,ICD患者在术前6 个月内应至少进行一次术前检查(可用远程监测检查)。484,485 对于起搏依赖、CRT双心室起搏,以及植入ICD且接受与电磁干扰 (EMI) 风险相关的择期NCS(例如涉及使用单极电凝,尤其是脐以上部位使用)患者,术前应立即进行CIED检查和重新程控。对于起搏器依赖的患者,应将设备重新程控为无感应或非同步起搏模式,以防止起搏器功能受到抑制。对于大多数型号的起搏器,以上措施可以通过在起搏器外壳上方放置磁体来完成。486,487 然而,除了Medtronic和 Sorin/Livanova/Microport 之外,现代起搏器中的磁体起搏模式是可调整的,但可能不是非同步起搏。因此,放置磁体并不是针对EMI造成起搏器故障的通用补救措施。此外,非同步起搏还可能会导致在T 波起搏而引发 VT或VF。然而,临床上发生显著EMI的风险还是很低487-489,一个实用的解决方案是通过体表心电图或动脉曲线进行监测,在 ECG出现停顿时要限制电灼刀的使用。
对于使用无导线起搏器且起搏依赖的患者,将起搏器程控为无感应模式后,可以安全地接受手术,预防措施与使用传统起搏器的患者相似,即避免发生EMI(鉴于无导线起搏器心内植入位置和缺少霍尔效应传感器/开关,磁体放置在该设备上方时不能临时程控为非同步模式)。490,491
对于接受NCS且预期有EMI风险的ICD患者,应在NCS之前限制ICD监测心律失常或抗心律失常治疗的功能,或在设备上方放置磁铁。作为磁体反应,所有现代 ICD 都会抑制抗心动过速治疗,同时保持缓慢起搏功能。通过程控关闭心电监测和心脏复律功能直到重新开启是不切实际的,此外,这样做还存在患者在设备未被重新开启的情况下出院的风险。考虑这些因素,目前更支持使用磁铁而不是关闭设备。对于一些病人,难以找到适合设备使用的磁铁,亦或磁铁无法使用或起搏器被强制程控。从开始直到重新启动ICD的整个过程,患者应该有连续的心电监测,并且应该有专业的、能及时发现心律失常、除颤和心肺复苏操作的人员在场。NCS结束后,建议尽快检查ICD功能并启动治疗功能。
皮下植入ICD 患者可在关闭抗心律失常治疗或设备表面放置磁体后进行手术。但是,如果计划进行胸外科手术,尤其是胸骨正中切口,外科医生应注意 ICD 的存在和皮下电极导线的走行,由此可避免导线的机械损坏、直接在电极上电灼或在靠近感应电极的位置进行胸骨切开。4 在起搏依赖、CRT和 ICD 患者中,应避免使用具有EMI风险的设备(例如电灼刀)。使用双极电灼刀、使用最低有效能量并将短脉冲发放限制在几秒内(<5 s)以及在远离设备 (>15 cm) 的地方使用笔或触控笔操作,可以最大限度地降低设备受到干扰的风险。在单极电凝的情况下,外科电刀电凝装置的连接方式应使电路远离 CIED外壳及其电极。然而,还应该考虑制造商的建议(通常建议将中性电极板放置在与手术电极位置相反的、血供丰富,肌肉发达的区域,但这样做可能临近手术部位)。因此,中性电极板应放置在离CIED尽可能远的地方,使手术部位保持在CIED和回路电极之间。(图15)494–497
对于使用植入式心电记录仪的患者(特别是那些没有进行远程监测和定期下载CIED存储记忆的患者),在接受可能存在电磁干扰的手术或在设备附近位置进行的手术前,应下载设备的存储记忆,以避免误诊以及将噪音记录为心律失常和存储记忆擦除。498,499
指南推荐表22 已知存在或新诊断心律失常患者围术期管理建议

指南推荐表23 缓慢性心律失常和携带心脏植入装置患者的管理建议

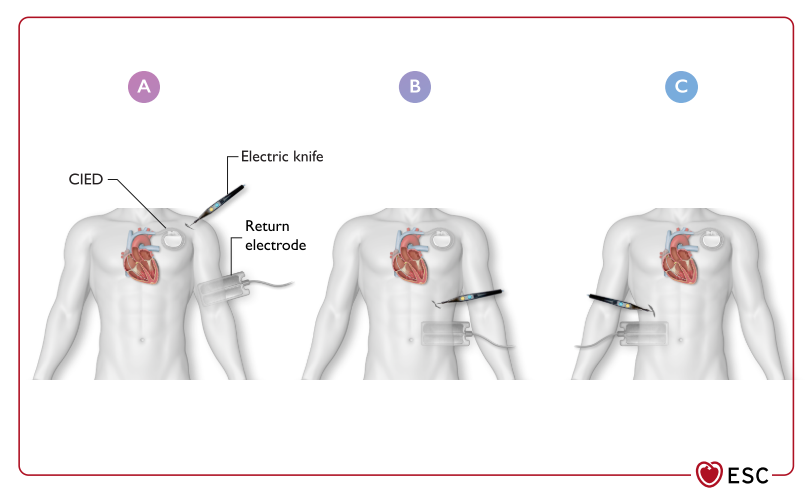
CIED,心脏植入电子设备;Electric knife,电刀;Return electrode,回路电极
图15 心脏植入电子设备患者接受单极电刀手术时,回路电极的最佳位置取决于手术部位。心脏植入电子设备。使用双极电灼烧,使用最低有效能量并以短脉冲输出(<5秒),在远离设备 (>15厘米) 处使用笔或触控笔进行操作可以最大限度地降低干扰设备的风险。(A) CIED上方同侧手术部位。(B) CIED下方同侧手术。(C)对侧部位手术。494
6.5 成人先天性心脏病
成人先天性心脏病(ACHD)占先心病(CHD)患病人群的>60%500,501。因此,在NCS入院的患者中ACHD的比例不断增加,可能是心血管事件的高危人群502。
ACHD术前风险评估需要关注基础疾病、手术类型、残留和后遗症。心衰、肺动脉高压、心律失常、低氧血症、其他器官损伤和心内膜炎的共存可能对这些患者的基线风险有很大影响,从无额外风险到预后不良的极高风险503,504。因此,应获得原始的医学和外科报告以及当前的数据,这些数据应包括症状、运动能力、血氧饱和度、实验室值 (BNP、血红蛋白、肌酐等) 和药物。
在最近的一份报告中,接受NCS的ACHD患者的绝对死亡率超过了4%502。与匹配的对照队列相比,ACHD患者的死亡率和围手术期发病率更高,严重ACHD患者的死亡率最高。众所周知,肺动脉高压合并艾森曼格综合征患者有更高的并发症风险505。一个大型注册研究证实了这些发现: 严重CHD患者30天死亡率、总死亡率和再插管的风险增加,而中度CHD患者的总死亡率和再插管风险中度增加506。基于本研究和最近的指南503,表13提出了ACHD行NCS的风险分层。
需要由ACHD专家进行会诊,尤其是对于中或重度ACHD拟行中高危NCS的患者。建议中和重度ACHD患者的择期手术应在有ACHD救治经验的中心进行。通常建议进行微创手术和麻醉,尽可能减少对血流动力学的影响。
在接受NCS的ACHD中,最佳的围手术期医疗始于适当的术前评估。ACHD可表现为多器官受累(肾、肝、肺和内分泌系统),在诊断时应考虑这一点503。在许多情况下,ACHD患者需终身接受OAC治疗或抗血栓治疗,主要是特定ACHD相关的心律失常或血栓栓塞风险增加所致。围手术期口服抗凝治疗应根据具体情况重新评估。CHA2DS2-VAS评分在ACHD患者中尚未得到验证,不应在ACHD患者中使用。
持续的血流动力学监测对ACHD患者是必要的,应包括有创的血压监测,特别是在中度或重度复杂的ACHD患者。值得一提的是,根据ACHD的类型或手术类型(如主动脉缩窄或行Blalock-Taussig分流术),需要注意进行持续血压和气体交换监测的动脉线的位置。持续存在右向左分流的患者,空气过滤器必须用于静脉通路。呼吸机管理和拔管可因限制性肺部疾病的存在而复杂化507。应根据2015年ESC指南对感染性心内膜炎进行抗生素预防432。此外,在具有ACHD患者治疗经验的ICU进行术后监护往往是必要的。
在这种情况下,应考虑延长监测时间,并特别关注心律失常和最佳容量管理,因为已有研究表明,高达50%的不良事件可归因于术后监测和护理的失误508。有两个特殊危险的群体是慢性紫绀和Fontan手术后的患者。慢性紫绀与多器官受累有关。此外,由于多个侧支、血小板功能障碍和凝血级联的改变,出血风险更高509。在艾森曼格综合征患者中,必须避免增加肺血管阻力的情况,如低温、代谢性酸中毒、高碳酸血症和低容量血症509。Fontan手术后的患者也是如此,静脉回流依赖于低肺循环压力。如果这些病人的腹内压升高过高,静脉回流会急剧减少,随之而来的是心输出量的下降。在行腹腔镜检查或开放性NCS治疗的患者中,应仔细考虑血流动力学方面的情况。


6.6 心包疾病
在非心脏手术患者中活动性心包疾病并不常见,但有潜在的生命危险。明确潜在病因(病毒或细菌感染、恶性肿瘤、系统性自身免疫疾病、代谢性或自身反应性疾病)对于围手术期管理至关重要。治疗以上原因引起的心包疾病应遵循2015年ESC指南中关于心包疾病诊断和治疗的建议。510
急性心包炎是推迟择期外科手术的明确指征。然而,对于不可推迟的非心脏手术,需要注意药物与药物之间的相互作用。常用的秋水仙碱主要通过肝脏代谢,仅10-20%通过肾脏排泄。秋水仙碱可增加对中枢神经抑制剂的敏感性,并具有抑制呼吸的作用。511 围手术期的显著不良事件包括腹泻、肾功能衰竭恶化,以及极少数情况下的骨髓抑制、肝毒性、瘫痪、抽搐和心肺功能衰竭。激素、白细胞介素-1受体拮抗剂等免疫抑制药物对免疫系统有抑制作用,围手术期使用可增加感染风险,并且延缓创面愈合。511
心包填塞是所有外科手术的绝对禁忌症,尤其是需要全麻的情况下。510,512 心包积液应在局部麻醉下经皮引流。对于少量或中等量慢性心包积液和缩窄性心包炎,应采取措施增加心脏前负荷。术前应优化前负荷,可在全麻诱导前静脉输液以促进心室充盈。应避免或尽量减少降低静脉回流的操作和药物。正压通气可导致前负荷急剧下降,因此应避免使用。如果患者不能自主呼吸,应考虑采用最小吸气压力(低潮气量、高呼吸率)的通气模式。应选择对心率、全身血管阻力、静脉回流和心肌收缩力影响最小的麻醉方式。189 氯胺酮是一种能维持自主呼吸通气的交感神经兴奋剂,可作为首选药物。联合应用阿片类药物、苯二氮卓类药物和一氧化氮时,无论是否使用低剂量的挥发性麻醉剂,都可以用于麻醉维持。此外,应首选对循环影响最小的肌松药,尽管泮库溴铵可轻度增加心率,但也是可以接受的。
推荐表25 合并心包疾病患者围术期管理的建议

6.7 肺部疾病和肺动脉高压
心脏病患者接受非心脏外科手术若同时合并肺部疾病,可能会增加手术风险。既往肺部基础疾病对围手术期风险影响较大,最常见是会增加术后肺部并发症的风险。尤其是进行腹部或胸腔手术,吸烟者的术后肺部并发症风险增加。某些呼吸系统疾病与心血管疾病的病理改变相关,除了究其肺部疾病本身外,可能还需要特殊的心血管风险评估和管理。其中特殊的肺部疾病包括慢性阻塞性肺疾病(COPD)、肥胖通气不良综合征和肺动脉高压(PAH)。
6.7.1 肺部疾病
慢性阻塞性肺疾病是患病率和死亡率重要病因。513 尽管COPD引起心血管疾病风险增加,但没有证据表明COPD与围手术期心脏并发症的高风险有关。但是术后肺部并发症能够导致严重的死亡率和发病率。使用特定的术后肺部并发症工具进行术前评估,可用于对高危患者进行分层,并实现最佳的术前和围手术期管理。514对于接受NCS治疗的COPD患者,术前治疗的目标是优化肺功能,尽量减少术后呼吸道并发症;这包括利用术前进行科普教育,包括戒烟(术前2月),指导胸部物理治疗和肺部扩张动作,肌肉耐力训练,以及必要时加强营养。对于所有症状的支气管高反应性的COPD患者,β-肾上腺素受体激动剂和抗胆碱能药物应当持续用到手术当天。某些情况下,也可以考虑短期使用静脉/吸入性糖皮质激素。如果存在活动性肺部感染,应至少应用10天抗生素治疗,对择期NCS应考虑延迟手术。515
肥胖通气不良综合征的标志性特征分别为肥胖、日间通气不良和睡眠呼吸紊乱的三联症。尽管和单纯的肥胖和睡眠呼吸障碍各异,但据估计90%的肥胖通气不良综合征患者也伴有阻塞性睡眠呼吸障碍(OSA)。肥胖通气不良综合征在成人中的发病率为0.15-3%,在接受减肥手术的患者中发病率为7-22%。516肥胖通气不良综合征增加心血管疾病的发病,包括HF(以及肥胖相关的心肌病)、心绞痛、肺动脉高压(30-88%)和肺心病,并增加围手术期的死亡率。肥胖通气不良综合征的高危患者在接受NCS治疗时,应转诊至专科进行睡眠紊乱呼吸和肺动脉高压的相应评估,术前启用适当的气道正压通气治疗,并在适当的监护下进行围手术期操作(麻醉和手术)和术后气道正压管理。
6.7.2 肺动脉高血压(PAH)
肺动脉高压与NCS患者的发病率和死亡率的增加显著相关。对这部分患者进行细致的术前评估诊断,应包括对功能状态和疾病严重程度,以及合并症和 类型进行评估。超声心动图和右心导管检查(如果有临床指征)是术前关键的评估内容。PAH相关的发病率和死亡率来自于右心系统后负荷急剧增加的血流动力学反应。519
既往研究报道,严重PAH患者的围手术期的死亡率在3-18%之间,这取决于基础疾病的严重程度,以及外科手术的性质和紧迫性。520,521评估PAH患者的围手术期风险时,应考虑与患者相关和与手术相关危险因素(表14)。522 由于急性右心衰竭和肺动脉高压危象,麻醉和外科手术风险可能变得异常复杂,PAH患者的择期NCS治疗应经过多学科团队中充分讨论。理想情况下,接受NCS治疗的PAH患者应在术前进行优化治疗,并在肺血管病中心进行管理。523 围手术期PAH患者的临床管理应遵循2022年ESC/ERS肺动脉高压诊断和治疗指南中的建议。524
一些旨在降低肺血管压力的新型治疗策略被用于接受NCS的患者的术前治疗。这些治疗中,内皮素受体拮抗剂、磷酸二酯酶抑制剂和前列环素类似物是使用最多的。525 围手术期应继续使用这种药物,因为治疗中断可能导致PAH的严重反弹。吸入型一氧化氮通过选择性地扩张肺血管,起效迅速,能够给术后肺动脉高压恶化的患者使用,以维持右心室(RV)功能和血流动力学稳定。
表格14-评估肺动脉高压患者围手术期风险时应考虑的与患者相关和与手术相关的因素

推荐表格26-评估肺动脉高压患者围手术期风险时应考虑的与患者相关和与手术相关的因素

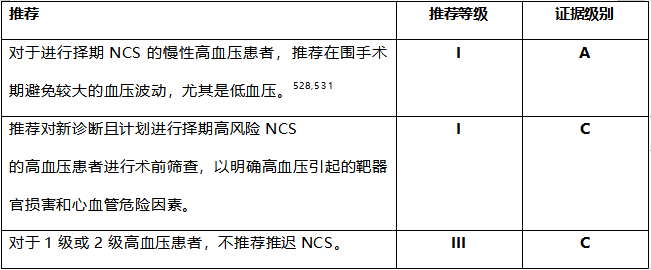
6.8 高血压
欧洲成年人动脉高血压的患病率为30-45%。527在这些患者中,<40%的患者血压控制良好(<140/90mmHg)。一项大型观察性研究表明,术前1个月未经治疗的高血压患者术后90天死亡率增加69%。183此外,总体心血管风险评估,包括寻找高血压导致的器官损伤,对于高血压患者至关重要,在新发现血压升高时是必须进行的。528
1级或2级高血压患者通常不建议推迟手术。相反,在收缩压≥180 mmHg和/或舒张压≥110mmHg,建议推迟手术直至血压得到控制,但急诊手术除外。236,527,529,530避免围手术期血压较大的波动似乎也很重要。最近的一项关于接受腹部手术的患者的随机试验中显示,采用个体化的治疗策略,将术中收缩压与术前诊室血压的差异控制在10%以内,可以降低了术后器官功能障碍的风险。528在一项包括130862名手术的患者的荟萃分析中,术中低血压与发病率(OR,2.08;95%可信区间,1.56–2.77)、死亡率(OR,1.94;95%CI,1.32–2.84)、心脏并发症(OR,0.44;95%可信区间,0.52–3.93)和AKI(OR,3.68;95%CI1.31–5.55)的风险增加有关。531在高血压患者中,低灌注可能发生在较高的血压水平,围手术期血压控制应恢复到术前水平。528
对于择期NCS的患者,应优先控制血压,尤其是收缩压>160mmHg的患者。术前高血压患者的管理应遵循2018ESC/欧洲高血压学会(ESH)动脉高血压管理指南中的建议。529这些指南提倡使用RAAS抑制剂(<70岁的患者)或CCBS(>70岁的患者)作为中度高血压的单一治疗,在需要双药治疗的情况下两者联合使用,如果需要进一步控制,则加用利尿剂和醛固酮拮抗剂。β受体阻滞剂被限制用于有特定指证的患者。529对于具有明确β受体阻滞剂适应症的高血压患者,三代β受体阻滞剂如卡维地洛、塞利洛尔、拉贝洛尔和奈比洛尔与其他β受体阻滞剂相比具有更好的抗高血压作用,且副作用更少,但目前没有RCT报告在高血压患者中的结局。在一项大型观察性研究中,在有三个或四个心脏危险因素的患者中,使用β受体阻滞剂治疗至NCS术前与30天死亡率降低相关。188然而,对于无心脏危险因素的患者,使用β受体阻滞剂后死亡风险显著增加。188,532
大多数在手术当天为3级高血压的患者被归类为高血压急症。在这种情况下,2018年ESC/ESH动脉高压管理指南推荐ACEIs、CCBs或利尿剂。但手术当天不建议使用ACEIS或利尿剂。一个包括11项CCBs研究的Meta分析支持了使用CCBS。220此外,一项对989名血压控制良好且无高血压相关靶器官损害的患者进行的研究,比较了在NCS当天诊断为3期高血压(收缩压为>180和/或舒张压为>110mmHg)时使用速效鼻饲硝苯地平,与恢复手术前延迟血压控制,发现两者之间的结局没有差异。533即刻给予硝苯地平治疗与更短的住院时间相关。由于这是第一项测试3级高血压患者是否需要延迟治疗的研究,它对这种做法的必要性提出了挑战。对于高血压急症患者(收缩压>180和/或舒张压>110mmHg和器官损害),2018年ESC/ESH动脉高血压管理指南建议根据受累器官使用拉贝洛尔、硝酸甘油、硝普钠等。529
高血压治疗药物的给药时间以及围手术期的延续或停药在5.2节中讨论。
推荐表27 高血压的术前管理推荐
6.9 外周动脉疾病
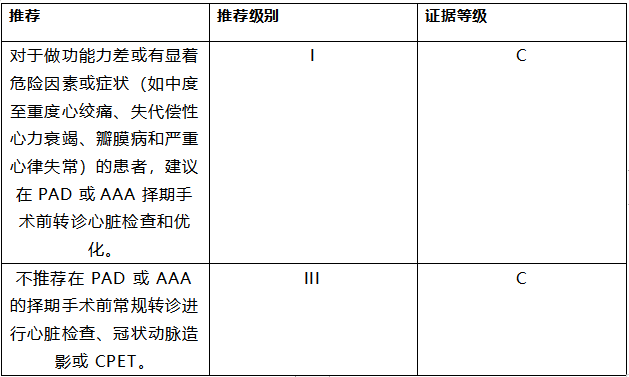
外周动脉疾病(PAD)患者通常有不同程度影响多个血管床的晚期动脉粥样硬化疾病,与没有外周动脉疾病的患者相比,其预后更差。[534-538] PAD 患者的风险特征通常不同,这取决于他们是否接受血管或非血管 NCS。
6.9.1 外周动脉疾病和非血管性非心脏手术
对计划进行非血管性 NCS 的患者预先存在的 PAD 和 AAA 进行术前治疗的决策应根据个体情况做出,同时考虑到手术的症状和风险。PAD 需要血运重建的患者应优先考虑非心脏手术,但有必要在围手术期仔细监测下肢灌注的恶化,特别是那些患有慢性肢体威胁性缺血的患者(例如,外周血压≤50-70 mmHg)足关节和脚趾≤30-50 mmHg)。[539]对于 AAA 患者,控制疼痛对于确保血压稳定、降低破裂风险至关重要。大 AAA 患者(即女性直径>0.5 厘米,男性直径>0.55 厘米)应在计划进行非血管 NCS 之前评估主动脉瘤修复(最好是 EVAR),尤其是在恶性肿瘤的情况下,取决于恶性疾病的阶段。[540-542]
6.9.2 外周动脉疾病和血管非心脏手术
2017 年 ESC 外周动脉疾病诊断和治疗指南和欧洲血管外科学会 (ESVS) 2019 年关于腹主动脉-髂动脉瘤管理的临床实践指南,为血管性 NCS 前的患者筛查提供了详细的证据和建议及其治疗方式的选择。值得注意的是,有随机证据反对 CCS 患者在进行大血管手术前进行预防性冠状动脉血运重建,因为在改善围手术期和长期预后方面缺乏益处(平均随访 2.7 年)。[399]在主要 NCS 之前评估做能能力有助于选择有心脏评估适应症的患者并提供指导,尽管严重的行走障碍可能会挑战这项测试。先前建立的用于检测接受选择性 AAA 修复的患者死亡率的风险预测模型可能会有所帮助。[543] 无论是否使用血管内或开放式手术,在下肢血运重建手术后 10 天内开始低剂量利伐沙班联合阿司匹林可减少接受下肢血运重建的患者的术后血栓事件(急性肢体缺血、截肢、MI、缺血性卒中和 CV 死亡), [544]其他联合药物的处理应遵循第 5.2 节中详述的建议。
推荐表 28——对接受非心脏手术的外周动脉疾病和/或腹主动脉瘤患者的管理推荐
AAA,腹主动脉瘤;CPET,心肺运动测试;
HF,心力衰竭;PAD,外周动脉疾病。
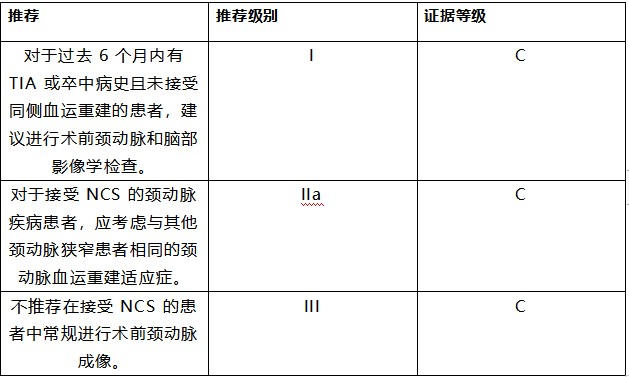
6.10 脑血管疾病
接受 NCS 的患者应询问以前的神经系统症状,如果合适的话,那些前6个月内出现提示短暂性脑缺血发作 (TIA) 或中风的症状的患者应进行术前神经系统会诊以及神经血管和脑成像。在缺乏专门研究解决这个问题的情况下,与 ESVS 合作,2017 年 ESC 外周动脉疾病诊断和治疗指南中详细描述了有症状和无症状患者的颈动脉血运重建标准;这些指南还应指导正在接受 NCS 的颈动脉疾病患者的管理。[535]
对于有症状的颈动脉疾病患者,颈动脉血运重建对近期(3 个月)TIA 或中风且颈动脉狭窄≥70% 的患者的益处特别高。因此,应首先进行颈动脉血运重建,并推迟择期 NCS。[545]
拟行择期主要 NCS 同时伴严重无症状颈动脉闭塞性疾病的患者是否需要术前颈动脉血运重建仍然存在争议。重要的是,在这种情况下,颈动脉血运重建的目的更多是为了长期预防卒中,而不是降低围手术期卒中风险。因此,如果需要进行颈动脉血运重建,可以在计划的 NCS 之前或之后进行。独立于血运重建策略,颈动脉狭窄患者受益于积极的 CV 危险因素控制,以预防围手术期心肌缺血。
推荐表 29——对疑似或确诊颈动脉疾病进行非心脏手术的患者的管理推荐
NCS,非心脏手术;TIA
6.11 肾脏疾病
肾脏疾病与多种心血管疾病相关,包括高血压、心力衰竭、冠心病和心律失常等疾病546。同样肾脏疾病增加了行非心脏手术的患者中发生术后心血管事件如急性心肌梗死、卒中和心力衰竭的风险。因此,在行非心脏手术患者的危险分层中常包括术前肾脏功能的评估。
慢性肾脏疾病(CKD)指的是持续至少3个月的肾脏功能受损或者蛋白尿增加。肾脏功能通常用估计的肾小球滤过率(eGFR)来评估,通过参数包括性别,年龄、种族、血清肌酐浓度在内的 CKD-EPI公式来计算eGFR。通常GFR<60ml/min/1.73m²与主要心血管不良事件相关。术前评估是否存在肾功能恶化的风险对于围手术期是至关重要的,以确定是否需要维持肾脏灌注的有效循环血量和使用血管升压药物547。
有心血管合并症的患者在主要NCS围手术期因为血液或体液的丢失、心血管活性药物的中断或连续导致的血流动力学紊乱,因此容易出现急性肾损伤(AKI)。对围手术期行非心脏手术患者要接受血管活性药物治疗的管理在5.2章节中来讨论。在基线肾功能正常的患者中出现急性肾损伤降低长期生存率548。有意思的是约30-40%的急性肾损伤发生在手术后,术后出现急性肾损伤约18-47%。术后发生AKI的危险因素包括心源性(失代偿或慢性心力衰竭,高血压,使用血管活性药物)和非心源性(年龄、性别,是否急诊手术,腹腔手术,术前肾功能不全,术前肌酐增高,慢性肾脏病,和糖尿病)549,550. 在住院患者中,不是否存在术前肾功能损害,术前低心输出量/高静脉压、和/或诊断和术中应用造影剂等是发生AKI的最常见原因。对比剂肾病提示应用造影剂后在48h内肌酐水平较基线增加44mmol/L(0.5mg/dl)或增加了25%(或在12h内增加5-10%)。在放射诊疗中,高达15%慢性肾脏病患者出现AKI551。尽管造影剂导致的急性肾损伤是自限性的,肾功能可能在7天内恢复正常,约0.5-12%的病例出现明显肾功能衰竭,增加了病死率。为了减低造影剂导致AKI风险,KDIGO指南推荐不管是否存在肾脏疾病,术前用等渗液体水化,用最低水平的造影剂或使用等渗的造影剂547。在术后,应该用已经建立的AKI评分系统对肾功能进行监测以提高警觉意识和早期的干预治疗552。
6.12 肥胖
在西方国家,超重或者肥胖的概率已经非常普遍557。肥胖是除了烟草外第二位导致可以预防的死亡的病因558。肥胖定义为BMI指数≥30kg/m², 病态性肥胖指的是BMI≥35kg/m²,超病理性肥胖指的是BMI≥50kg/m²。肥胖是导致心血管疾病及死亡的危险因素559,同时也是外科手术发生不良事件风险增加的一部分人群。对于肥胖患者,不论术前心脏情况如何,术前有特殊的管理策略560。然而尽管肥胖可以增加心血管疾病的发病风险,但是超重患者的心血管预后要好于瘦弱患者,这种现象被认作是肥胖悖论561,562。相似的是,在手术后或长期随访中,轻度肥胖患者的死亡风险较低体重或者正常体重的患者要低563。这些发现可能与肥胖患者在非心脏手术中发生围手术期急性心肌损伤(PMI)概率低相关564。
在肥胖患者中,建议采用心肺适应性(CRF)而非BMI指标来评估心血管疾病风险。尽管BMI在临床实践操作中简单,容易操作和被接受,但是并没有真正反映脂肪的分布和体脂的组成。CRF指的是在运动中呼吸和循环功能向肌肉供氧的能力,这对于有心血管疾病患者而言是至关重要的。评估CRF的主要指标是最大摄氧量(VO2max)。在对接近10000名合并冠心病的患者长达15年随访中发现,那些较高CRF患者预后更好566。然而低的CRF是死亡的主要预测因子,与体重无关561,567。然而对于合并心血管疾病的肥胖者患者的治疗策略是否需要优化目前还存在争论。目前在行非心脏手术患者中发表的研究中,降低体重(低热量因素或体育锻炼)对临床预后包括围手术期发病率和死亡率的影响得到不一致的结果568,569。
推荐表30 对于合并肾脏疾病患者行非心脏手术处理策略

推荐表31 对于肥胖患者行非心脏手术处理策略

6.13 糖尿病
由于接受外科手术的人口的逐渐老龄化和世界范围内肥胖发病率的增加,接受NCS患者的糖尿病患病率预计在未来几年将增加。4,571一些研究表明,接受NCS治疗的糖尿病患者比非糖尿病患者有更高的冠心病患病率。此外, 由于心脏神经疼痛通路的改变,糖尿病患者更有可能出现无症状心肌缺血。572因此,糖尿病患者术后发生心肌缺血的风险似乎更大。糖尿病与NCS 患者围手术期死亡率增加之间的关系存在几种不同的原因。首先 ,已知糖尿病患者在进行手术时往往具有更多的合并症和/或进展期冠心病。 第二,糖尿病是脑卒中的一个明确的危险因素。糖尿病与术后充血性心力衰竭的发生和伤口感染有关。而且,许多糖尿病患者已存在肾功能损害。计划接受NCS治疗且存在或新诊断的糖耐量受损的患者应遵循2019年ESC指南中对糖尿病、糖尿病前期和心血管疾病人群的建议,573包括提高对可能的亚临床器官损伤的认识。
建议对计划行NCS的所有糖尿病或糖耐量受损患者应进行糖化血红蛋白(HbA1c)检测,除非近3个月进行过该项检测。有证据支持,对于计划进 行择期NCS的患者,入院前良好的血糖管理可有效降低术后CV事件的风险,包括心肌梗死、卒中和心衰进展。574相比之下,在接受NCS治疗的患者中,术中血糖水平与随后的手术部位感染、心肌梗死、中风和死亡风险之间并没有明确的关联 。575关于而且,关于二甲双胍相关的酸中毒的发生风险也存在一定争议。576 然而,仍建议在手术当天重复监测血糖,已达成普遍共识维持围手术期血糖水平≤10.0 mmol/L而不引起低血糖(目标水平 为5.6-10.0 mmol/L)。这可以通过皮下注射速效胰岛素类 似物或静脉注射胰岛素来实现。577关于SGLT2抑制剂与手术之间的关系已在第5.2节中讨论过。
推荐表32-进行非心脏手术的糖尿病患者的治疗推荐

6.14 癌症
由于癌症患者通常年龄较大,因此其合并心血管疾病风险因素及心血管疾病的发病率均较高,从而使其成为NCS患者中发生不良事件风险较高的人群。因此,按照本指南其他章节中提供的一般性建议和关于特殊疾病的建议,在NCS前优化针对心血管风险因素和已知心血管疾病的治疗是非常重要的。此外,由于患者前期进行过潜在的心脏毒性的化疗或由于之前的辐射导致的纤维化,使得NCS在癌症患者中可能特别具有挑战性。例如,广泛使用的蒽类药物与HF的发生率呈剂量依赖关系,使用曲妥珠单抗可能导致重要的心脏毒性,以上均应在术前评估中予以考虑。另外,对包括心脏在内的区域进行放射治疗可能导致过早的CAD和VHD;既往胸部放射治疗可能使年轻患者易患心脏病,否则这些患者不会有患病率升高的风险。在接受癌症手术的患者中经常观察到术后房颤,据报道,肺手术的房颤发生率最高。并且,由于疾病本身以及患者和治疗相关因素,癌症患者血栓形成的风险增加。在一项针对计划接受腹部或盆腔肿瘤开放手术的患者的小型研究中,与应用1周的依诺肝素患者相比,预防性使用依诺肝素4周的患者可降低血栓形成的发生率(依诺肝素组为4.8%,安慰剂组为12.0%;P=0.02)582。尽管后来的研究显示了一些相互矛盾的结果,但一致的意见是建议在主要腹部和/或骨盆肿瘤手术后4-5周内进行预防性抗栓治疗,首选使用低分子肝素583。可能影响围手术期风险的患者相关因素和癌症治疗相关因素汇总如表15所示。更多信息可参见2022年ESC心脏肿瘤学指南584。
表15 影响癌症手术围手术期风险的因素及预防策略

6.15 2019冠状病毒病
2019冠状病毒病(COVID-19)是一种由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的传染病。最近的一项观察性研究显示,在计划接受NCS的140231名患者中,有2.2%的患者术前诊断为SARS-CoV-2感染585。与无SARS-CoV-2感染史的患者相比,围术期或近期感染SARS-CoV-2的手术患者,术后VTE和死亡率似乎增加586。此外,源于COVID-19感染相关的可能心肌损伤,可能会增加与手术相关的围术期不良心脏事件内在风险587,588。
目前,对于计划进行NCS的患者,在新冠肺炎感染后还没有特定的心血管筛查。除了指南中描述的一般风险评估外,对这类特定亚组患者,与NCS相关的心血管风险术前评估应包括:新冠肺炎的严重程度、感染期间心血管并发症史以及康复后的做功能力,这些方面对于进一步优化手术时机和治疗影响NCS围术期风险的新冠肺炎相关CVD具有重要意义589。
有新冠肺炎感染史的患者接受NCS的最佳时机在很大程度上是未知的。一般情况下,择期NCS应推迟至合并疾病的完全恢复和最佳化。来自新冠肺炎感染后接受NCS患者的登记数据显示,新冠肺炎确诊7周内死亡率和并发症的风险增加586。另一项研究则报告,在新冠肺炎确诊8周内具有更高的术后并发症风险590。然而,应该注意的是,几乎所有研究数据都来自疫苗接种率为零或很低的时期,而且缺乏感染Delta和奥密克戎变异株后康复者的可靠数据。
美国麻醉师协会和麻醉患者安全基金会发表的一份关于新冠肺炎感染后患者择期手术和麻醉的联合声明591建议,对于未接种疫苗且在SARS-CoV-2感染后无症状的患者,将择期手术推迟7周。应考虑新冠肺炎感染的临床病程、急性期和晚期心肺症状的出现和强度,以及既往存在的合并症。此外,应注意持续存在的新冠肺炎症状,如疲劳、气短和胸部不适,因为这与较高的术后死亡率有关,与新冠肺炎诊断的时间无关588,589。目前证据不足以为接种疫苗后感染的患者提供建议。
第7章 围术期监护和麻醉
7.1 围术期监护
尽管缺乏前瞻性随机对照试验来研究围术期监测与预后的相关性,但既往证据明确表明,常规使用监护可提高外科手术的安全性。建议术中常规监测心血管和呼吸系统、体温、神经肌肉传导和麻醉深度592,593。
常规心血管监测包括心电图、自动无创血压和脉搏血氧饱和度监测。近红外光谱最近被用于评估局部组织的灌注和氧合情况。在某些情况下,可以应用更多的有创监测技术,如通过动脉导管连续监测动脉血压和心输出量。即使总血容量的变化高达30%,平均动脉压和心率仍保持稳定594。右心导管术可用于连续测量中心静脉压和/或肺动脉压、肺动脉楔压(反映左心室舒张压)和心输出量。然而,这些是静态变量,不能可靠地反映心血管的充盈状态,但可准确地指导50%的患者进行液体治疗595。
虽然在NCS期间不鼓励常规使用肺导管,但使用动态变量,如每搏量或脉压变化,已成为金标准。此外,TEE越来越多地被用作累及心脏的大手术和心脏手术期间的术中监护手段。在NCS期间,关于围术期监测程度和具体策略实施的决定应始终基于以患者为导向的个体评估,并考虑手术的严重性和患者的身体状况。围术期呼吸系统的基本监测包括脉搏血氧饱和度和二氧化碳分压;这两种方法均为无创,易于应用。脉搏血氧饱和度测定仪可以在体内测量动脉血氧饱和度,二氧化碳测定仪可以测量呼吸时的呼气末二氧化碳浓度;这些监护仪还可以提供有关整体血流动力学状态的信息。
围手术期间必须定期关注患者本人,而不依赖麻醉技术和不同监测系统提供的信息 596。此外,还应在适当时检查失血和尿量,以及整体临床状态597。需要特别注意声音警报的启动和设置,因为使用不当或未能响应术中警报,可能会导致不良后果及给患者带来危险598。
7.2 麻醉
麻醉医生、心脏病医生、外科医生和其他相关专家之间应密切沟通商讨患者病情,以决定最佳的围术期策略。此外,任何所提出的策略都必须告知患者并与其讨论。与患者进行知情讨论,描述术前、围术期和术后护理阶段计划的患者路径和期望,以及对工作人员和周围环境的期望,应使用清晰、简洁和简单的描述。欧洲麻醉学会发布了对接受择期非心脏手术的成年人的术前评估:欧洲麻醉学会2018最新指南560。本部分重点讨论对于有心血管病和危险因素的患者而言极其重要的问题,并结合这些患者围术期处理的最新进展。
7.2.1 术中血流动力学
大多数麻醉技术会降低交感神经张力,这将引起静脉系统顺应性增加、血管扩张和血压降低,导致静脉回流减少。因此,在麻醉管理中,维持足够的器官血流量和灌流压非常重要,尤其对于脑循环功能受损的患者。多年来,人们已经认识到保持围术期血流动力学稳定的重要性599。
在过去的几年里,几项研究集中于术中低血压与术后预后的关系。最近的一项系统综述涵盖了42项研究,这些研究针对各种绝对和相对术中低血压定义与NCS术后不良预后之间的关系214,结果表明,当平均动脉压降至<80 mmHg且≥10min时,可能会发生器官损伤(心肌损伤、卒中、急性心肌梗死),并且这种风险随着血压的逐渐降低而增加。然而,大多数纳入的研究都采用了回顾性的观察设计,患者特征存在很大的变异性。此外,在纳入的研究中,术中低血压的定义差异很大。最近一项关于术中低血压发生率与低血压临界值定义的关系的研究,描述了48种不同的术中低血压定义,当将这些定义应用于在全麻下接受NCS的15509名连续成人患者的队列中时,41%的患者会出现收缩压低于80 mmHg的情况,93%的患者至少有一次收缩压低于基线20%;文章中定义的低血压界值与术中低血压发生率之间关系的累积发生率呈S形曲线,术中低血压发生率在5-99%之间600。目前似乎还没有一个通用的指标来定义术中低血压。此外,在对术中低血压的研究中,定义低血压的界值和选择的术中低血压模型方法都影响术中低血压与预后的关联601。因此,关于术中低血压的不同研究是无法比较的,已报道结果的临床结论仍然是没有价值的。最近一份专家共识声明指出,术中60-70 mmHg的平均动脉压与心肌损伤、急性心肌梗死和死亡相关。这些并发症与低血压的严重程度和持续时间有关602。纠正术中低血压是否能改善术后的预后仍有待证实。截至目前,只有一项包括292名患者在内的多中心随机对照试验研究,该研究明确了个体化的血压管理策略是否可减少术后并发症,结果表明,与标准做法相比,将收缩压控制在正常静息时的10%以内的个性化管理策略,术后器官功能障碍的发生率显著降低(分别为38.1%和51.7%)528;这些发现支持个性化管理的优点,尤其是对于存在心脏并发症高风险的外科患者。重要的是,要重视病理生理学在解释术中低血压的潜在机制方面的重要性,同时考虑到患者合并疾病的范围和严重程度;只有这样,才能针对术中低血压的原因进行对应的治疗(图16)。
术中低血压的严重程度由平均血压较基线的下降程度和低血压的持续时间来决定。术中低血压的潜在机制需要明确:交感神经抑制伴血管扩张、低血容量或其他更复杂的原因,如围术期心脏衰竭。一旦明确了潜在的原因,就可应用针对性的治疗策略。这包括是否应该在术前24小时中断特定的慢性血管活性药物,如ACEI或ARB 216。第五节详细分析了不同的慢性心血管药物治疗的策略。值得注意的是,术后结局不仅受术中低血压的负面影响,而且还受术后最初四天的低血压事件的影响603。对于成年非心脏手术患者,尽管血压>160mmHg与心肌损伤和心肌梗死相关,但没有足够的证据建议动脉血压上限达到多少时应该开始干预602。
术中心动过速可能对心肌氧平衡产生不利影响,从而导致围术期心肌损伤。一项对41140名患者的回顾分析发现,心率≥90 bpm与心肌损伤的风险增加有关604,这与非心脏手术患者血管事件队列评估(VISION)试验中观察的结果相似605。一项对具有高危风险的外科患者的分析发现,心率>87 bpm(术前心肺运动试验前静息状态记录的)与不同的心血管表型密切相关,这可能解释了非个体化治疗的意外不良后果,即旨在减少术中心动过速而忽略了其他血液动力学因素606。最后,近期的一项研究评估了术中心动过速与术后心肌损伤和全因死亡率之间的相关性,这项研究的主要发现是术中心率>90 bpm与复合终点事件缺乏相关性;HR>80 bpm或>100 bpm也与复合终点无关607。术中心动过速与围术期的不良结局是否有关,仍然存在争议。然而,考虑将术中心动过速作为血流动力学受损的指标似乎是可取的。
图16 处理术中低血压的病理生理学途径;a例如,围术期心肌衰竭

7.2.2 麻醉剂的选择
在重要功能得到充分支持的情况下,麻醉剂的选择被认为对患者的预后影响不大。来自外科心脏血运重建的证据表明,与静脉注射相比,吸入麻醉方案与术后肌钙蛋白释放较少相关,对临床结局无影响599,608。最近的一项大型多中心随机试验发现,与静脉注射相比,吸入麻醉方案对12个月死亡率的影响是中性的609。在NCS中,术后心脏事件的发生率与选择吸入或静脉麻醉方案无关610。
7.3 局部区域技术
神经轴镇痛的镇痛效果已得到充分证实。硬膜外镇痛的主要围术期适应症包括腹部大手术和开胸手术。硬膜外镇痛可能带来的其他益处,如恢复更快和术后并发症减少,但仍存在争议611,612。
神经轴镇痛可引起交感神经阻滞。当达到胸部第4皮节时,心脏交感神经张力可能会降低,随后心肌收缩能力、心率和心脏负荷会发生变化。没有专门的研究针对心脏病患者神经轴麻醉相关结果的变化。心脏病患者经常服用各种干扰凝血的药物;因此,在应用神经轴阻滞时,应注意确保有足够的凝血功能613。
目前的研究集中在神经轴镇痛的替代方案,对接受NCS且伴有心脏合并症的患者围术期疼痛控制具有类似效果,包括替代性镇痛技术,如静脉注射镇痛、持续伤口浸润、椎体旁阻滞和选择性神经阻滞。
7.4 围术期目标导向的血流动力学治疗
目标导向治疗旨在通过使用预设的血流动力学指标来优化前负荷和肌力功能,从而优化心血管功能,以实现正常甚至超常的组织氧气输送。与以临床体征或动脉压为导向的标准治疗相反,目标导向治疗基于血流动力学变量的流量或流体反应性,如每搏量、对流体挑战的反应、每搏量或脉压变化、心输出量的类似优化。目标导向治疗最初是基于使用肺动脉导管。最近开发了微创技术,包括:经食管多普勒、经肺稀释技术和高级压力波形分析。在合适的患者中,采用明确设定的方案进行早期目标导向液体治疗,已证明可降低术后死亡率和并发症的发病率614–618。
7.5 术后管理
几项研究表明,可以通过简单的手术Apgar评分对术后并发症和死亡率进行分层。这种分层可能会使患者被重新分配到更高级别的监护病房。EuSOS小组的结果强调了这种风险分层的重要性。在这项为期7天的队列研究中,包括来自28个欧洲国家的498家医院的46539名成人NCS患者:1855名患者(4%)在出院前死亡,其中1358名患者(73%)在术后的任何阶段均未接受重症监护。在过去的几年里,这种抢救失败的概念在围术期医学中得到了很大的关注,并提出了解决这个问题的策略619-622。
5%-10%的患者术后会出现剧烈的疼痛,这将增加交感神经张力并延迟康复623,624。最近的一项研究表明,接受NCS的患者术后72小时内的时间加权平均疼痛评分与心肌损伤显著相关625,该发现强调了有效的术后止痛对于降低术后心血管风险的重要性。
非甾体抗炎药(NSAIDs)在接受NCS的心脏病患者术后止痛中的地位是有争议的。双氯芬酸的心血管风险在所有非选择性NSAIDs中是最高的626,627。布洛芬的心血管风险似乎与塞来昔布相当628。与双氯芬酸和布洛芬相比,萘普生具有更好的CV安全性629,630。一项随机试验发现帕瑞昔布和伐地昔布未增加接受NCS患者的血栓栓塞事件。一项纳入32项随机试验的荟萃分析表明,帕瑞昔布/伐地昔布与安慰剂相比,未增加CV风险631。一项纳入10000名接受关节置换术患者的单中心观察性研究,发现使用NSAIDs与术后心肌梗死之间没有关联632。相反,另一项纳入三项随机试验(包括2604名大手术患者)的荟萃分析发现,COX-2抑制剂组的MACEs增加了2.3倍。在ESC心血管药物治疗工作组的立场文件中建议,除阿司匹林之外的NSAIDs一般不用于已确诊或有CVD高风险的患者633。
推荐表33 围术期监测和麻醉的建议

第8章 围手术期心血管疾病并发症
发现围手术期心血管并发症也是一项特殊挑战。首先,围手术期心肌梗死/心肌损伤(PMI)是最常见的CV并发症,但由于麻醉和镇痛,90%的患者并无症状,因此在没有PMI监测的情况下常常被遗漏。41,101,111,413,636–641再者,术后疼痛、恶心、手术伤口和引流等因素都可能会干扰急性心脏疾病的早期识别,如PMI、Takotsubo综合征、快速心律失常、急性心衰等。第三,心脏病专家通常不直接参与术后护理;因此,心脏并发症的早期发现和早期治疗是由非心脏病专家进行的,常常缺乏早期发现急性心脏疾病的培训。考虑到心脏并发症的相对较高的发生率、发病率和死亡率,以及有效治疗的可行性,建议在接受中高风险NCS的高危患者(已知的CAD、PAD、胰岛素依赖型DM或心脏疾病的症状)中,提高认识并监测PMI。41,101,109–111,118,413,636–639,642,643所有措施需要与外科医生协商并保持一致。
慢性心脏疾病,如冠心病,似乎为术中和术后的心脏并发症提供了基础。41,413,636,637几种相关的慢性疾病(如糖尿病和肾功能不全)很可能存在未确诊的心脏病,也与围手术期心脏并发症密切相关。(图17)41,413,636,637
急性情况,如创伤、手术和麻醉本身,会引起交感神经系统的激活、炎症、应激、高凝状态和分解代谢状态,所有这些都可能引发心脏并发症。41,413,636,637虽然NCS术后心血管并发症的风险在近围手术期最高,但在3-5个月的长时间内,这种风险似乎仍在增加。8
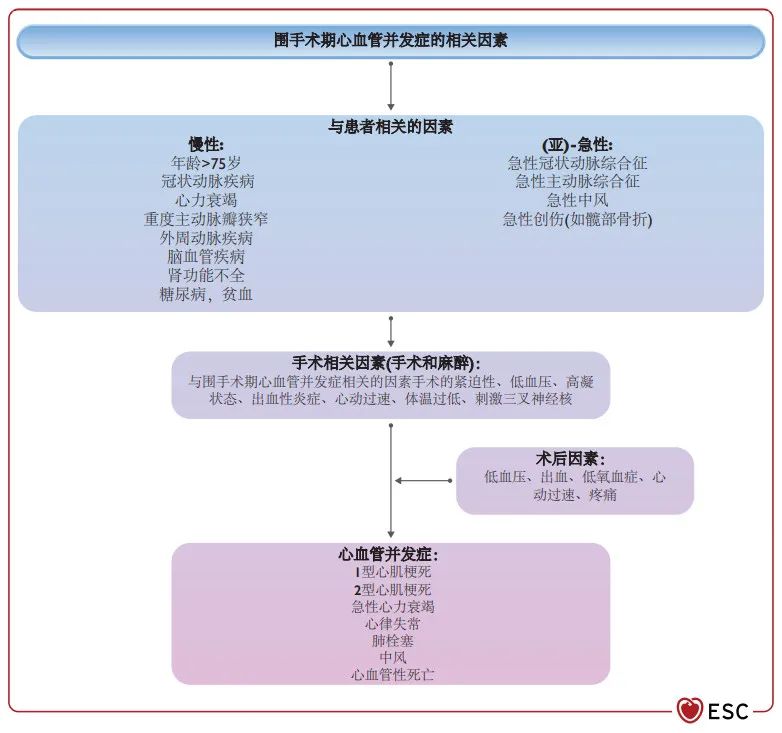
图17 围手术期心血管并发症的相关因素。SNS交感神经系统。
8.1 围手术期心肌梗死/损伤
围手术期心肌梗死/心肌损伤(PMI)是指急性心肌细胞损伤(术后hs-cTn T/I释放),伴或不伴随临床症状,有或无急性心肌缺血的心电图或影像表现。围术期心肌梗死只有在术前和术后(如术后24小时和48小时)连续监测hs-cTn T/I的PMI监测下才能可靠、快速地检测到。在BASEL-PMI研究中,约15%的既往有CAD/PAD或年龄>65岁的接受主要NCS治疗的患者出现了PMI。8由于大多数PMI发生在术中或术后即刻,在此期间使用了大剂量的麻醉药和/或镇痛药,90%患者的PMI没有典型症状,因此在常规临床实践中经常被遗漏。41,101,111,413,636–639这是一个主要问题,因为与PMI相关的死亡风险在没有症状的患者中也很高。41,101,111,413,636–639同样,在没有额外的心电图和/或心肌缺血影像证据的患者中,与PMI相关的死亡风险很高。8,41,101,109–111,118,413,564,636–639,641总的来说,发生PMI的患者的30天死亡率为10%。8,41,101,109-111,118,413,564,636–639,641目前还没有任何一种干预措施被证明在预防PMI方面是明确有益的。185,644
需要强调的是,PMI并不是一种同质性疾病。PMI可能是几种不同的病理生理学和临床表型的基础(图18)。根据第四版心梗统一定义,PMI患者还需要至少一个额外标准满足围手术期心肌梗死的定义(缺血性疼痛;缺血性 ECG 变化;新发存活心肌损失的影像学证据,或符合缺血性病因学的新发局部室壁运动异常;冠状动脉血栓)。643
由于最初通常不清楚患者最终是否会符合围手术期心肌梗死的标准,因此在初始评估中首选广义PMI定义。为了正确解释术后hs-cTn T/I浓度升高的病因,需要术前的基线水平确定其升高是急性的还是慢性的(见第4节)。643为了确定潜在的病理生理学并确定因果治疗,系统的随访和早期区分主要非心脏原因(如严重脓毒症、PE)和寻找不同的心源性病因(包括1型MI、2型MI、快速心律失常和急性心力衰竭)至关重要(图18和19)。经胸超声心动图有助于为大多数PMI患者提供信息。
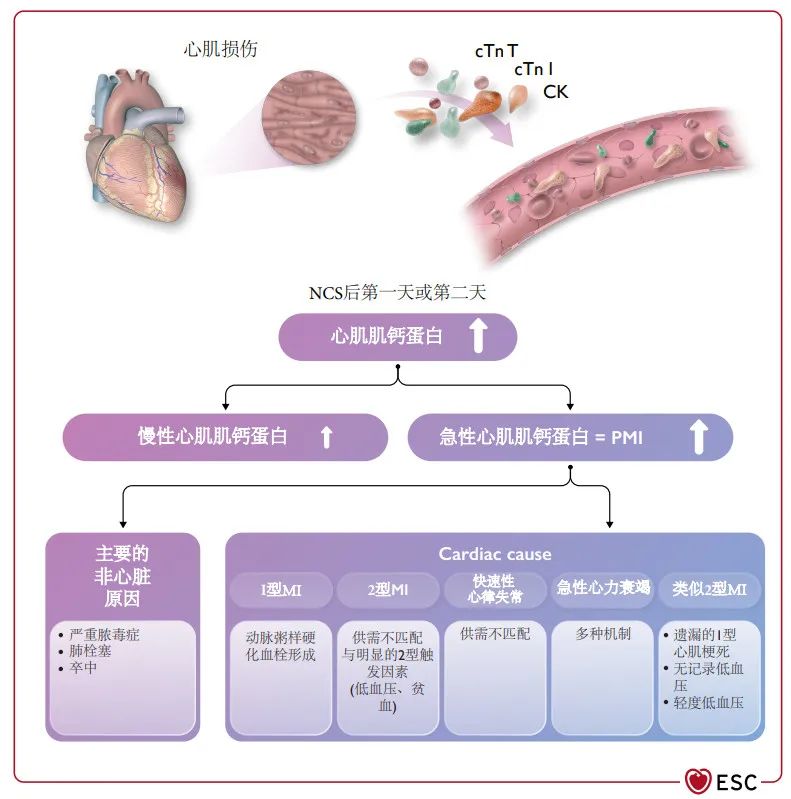
图 18 术后心肌肌钙蛋白升高的鉴别诊断。CK,肌酸激酶;cTn l,心肌肌钙蛋白I;cTn T,心肌肌钙蛋白T;MI,心肌梗死;PMI,围手术期心肌梗死/损伤。请注意,在围手术期环境中,医生对1型心肌梗死与2型心肌梗死分类的准确性可能低于非手术环境。647

图19 围术期心肌梗死/损伤的系统检查(病因学)和治疗。CCTA,冠状动脉CT血管造影术;ECG,心电图;Hb,血红蛋白;ICA,有创冠状动脉造影术;MI,心肌梗死;N,否;ST,ST段;Y,是;大多数2型MI和静止型MI患者应该在出院后作为门诊患者进行负荷成像或CCTA/ICA,这取决于手术前或手术后的症状和已知的CAD。
a或者是活动性出血。b或其他类型的心肌梗死触发因素,如低氧血症、心动过速、高血压。
c冠状动脉支架术后双重抗血小板治疗。d可能结合使用达比加群110 mg b.i.d.
术语NCS后的心肌损伤(MINS)已经用于特定一组心脏PMI患者,在没有非典型外科生理应激的情况下,心肌细胞损伤被认为最有可能是由于CAD伴心肌缺血(即,继发于供需失匹配或血栓形成),并且没有CAD以外的心脏病因的证据,例如快速房颤、急性心衰。101,109,638,641,642,645,646在大约一半的PMI患者中,基本的病理生理学不能基于普通的病历记录而明确,有可能是由于无文件记录的或相对低血压引起的2型MI,但也可能包括遗漏的1型MI,或在术后尚未进行CT血管造影的情况下遗漏的PE。110,647因此,重要的是要强调,PMI监测也有助于发现需要紧急治疗的主要非心脏疾病,如PE,在没有监测的条件下会遗漏。
PMI的发病率取决于患者相关因素、手术相关因素和术后因素,以及心脏标记物能检测到的最小程度的急性心肌损伤,由术后hs-cTn T/I浓度较术前的绝对增加确定(例如,正常上限的第99百分位)。8,41,101,109–111,118,413,564,636–639,641,648
术前肌钙蛋白高于正常值上限的绝对增加一直被证明与30天和长期死亡率以及其他术后非致死性心脏并发症的增加有关,并且可以很容易地通过每一种hs-cTn T/I检测来确定。因此,推荐临床使用此阈值。8,41,101,109– 111,118,413,564,636–639,641,648然而,关于最佳阈值还需要进一步的研究。新出现的数据表明,对PMI的监测具有成本效益。117,119确定最可能的病理生理学机制对于选择最合适的治疗至关重要。来自大型单中心回顾性队列的证据表明,心脏病学家参与这些患者的检查和治疗与较低的死亡率相关。649
不同表型心血管并发症之间的死亡率差异很大:30天全因死亡率和30天CV死亡、危及生命的心律失常、手术第3天后发生的急性心肌梗死和心脏失代偿在急性心力衰竭和主要的非心源性的PMI,如严重脓毒症或PE患者中最高;1型心肌梗死和快速心律失常居中,可能在2型心肌梗死中的轻度升高110。尽管其证据有限,2型心肌梗死患者通常采用1型心肌梗死的治疗策略。
在一项随机、安慰剂对照试验中,1754名患者(平均年龄70岁)在NCS后(主要是骨科、普通和血管手术的)发生MINS,被随机分配(1:1)接受达比加群110 mg口服b.i.d.或在MINS治疗后35天内使用匹配的安慰剂;650其中60%的患者已经在服用阿司匹林或P2Y12抑制剂。与MINS诊断相关的hs-cTn浓度的中位数峰值为82 ng/L。超过90%的MINS事件发生时没有临床症状或心脏缺血症状。达比加群/安慰剂在术后中位数6天开始使用,服用研究药物的平均时间为9个月。在随机分配接受达比加群(n=877)或安慰剂(n=87)的MINS患者中,与安慰剂相比,接受达比加群的患者出现主要血管并发症(包括血管死亡率、心肌梗死、非出血性卒中、外周动脉血栓形成、截肢和症状性VTE)的转归较少(达比加群的877名患者中有97人[11%],安慰剂的877人中有133人[15%];HR, 0.72; 95% CI, 0.55–0.93; P = 0.0115 ),且没有增加大出血事件。基于这些数据,在患有MINS和低出血风险的患者中,可考虑在NCS术后1周左右开始口服达比加群110mg bid.进行治疗。
8.2 自发性心肌梗死(第2天后)
对于既往有明确CAD、PAD或年龄>65岁的行大型NCS的患者,术后第2天的自发性心肌梗死发生率在30天内约为0.5%,在365天内为1-2% 8。在术后短期内(<5天),出血是一个主要问题,要根据手术部位和范围有限制地使用抗血小板和抗凝治疗。否则,应按照专门指南的建议,与心肌梗死治疗原则相同。98,171
8.3 Takotsubo综合征
围手术期Takotsubo综合征的发病率仍然未知,因为在PMI检查期间,没有一项PMI筛查研究在所有患者中使用超声心动图。非手术环境中诊断意识的提高导致Takotsubo综合征的检出率大幅增加,因此强烈鼓励在PMI的检查中使用TTE。有些证据表明,围手术期Takotsubo综合征的发病率也可能高于预期。8,41,101,109– 111,118,413,564,636–639,641,644
8.4 急性心力衰竭
在既往有明确的CAD、PAD或年龄>65岁并接受大型NCS的患者中,术后急性心衰的发生率在30天内为1-2%,在365天内为4-6%。8术前诊断或未诊断的慢性心衰、围手术期和术后的容量负荷是其发生的重要因素。由于目前尚缺乏专门针对术后急性心衰的研究,因此应沿用急性心衰诊断检查和治疗的一般原则651。
8.5 静脉血栓栓塞
围手术期VTE的发病率目前尚不清楚且可能报告不足,这可能是由于尚缺乏系统的筛查方法和诊断工具(如D-二聚体、典型疼痛症状),并与较高的围手术期死亡率(-17%)相关。322术后VTE/PE的危险因素包括手术类型(如高危髋关节置换术、开放性前列腺切除术、恶性肿瘤开放手术)、急性肾功能不全、心肌梗死和术后感染。322栓塞程度的分层(如大面积、亚大面积和亚段;高风险、中高/低风险和低风险)对于预测死亡率和指导治疗策略非常重要。652无明确原因的PMI患者应怀疑肺栓塞。密切的血流动力学监测和右心室功能监测(超声心动图、CT)对于确定哪些PE患者需要积极治疗至关重要。由于近期大手术或创伤是溶栓或抗凝治疗试验的禁忌症,因此目前缺乏关于术后PE患者充分抗血栓治疗的证据653。小样本系列研究支持在大规模PE患者中使用全身溶栓、手术取栓、或导管导向治疗。654一般来说,应尽早开始抗凝,最好使用低分子肝素或磺达肝素钠652。根据术后肾功能和出血风险,应尽早开始口服抗凝治疗至少3个月,且优先选用NOAC,因为其出血风险较低。652
如果可能,根据出血风险,建议对术后抗凝治疗的PE和血流动力学恶化患者进行抢救性溶栓治疗。652对于抗凝治疗中血流动力学恶化的患者,尤其是出血风险高的患者,应考虑将手术取栓或经皮导管导向治疗作为大面积PE溶栓治疗的替代方案。
8.6 心房颤动及其他相关心律失常
术后房颤定义为术后即刻新发的房颤;其发病率在2-30%之间,术后2-4天发病率最高。55,656虽然许多术后房颤发作是自行终止的,有些是无症状的,但术后房颤动与心脏手术后5年内房颤复发的风险相关,而NCS后复发的风险则不太清楚。656–660重要的是,与非手术后房颤患者相比,术后房颤是中风、心肌梗死和死亡的危险因素。656,658,661 术后房颤还可能导致血流动力学不稳定、住院时间延长、感染、肾脏并发症、出血、住院死亡增加和医疗费用增加。662–664图20概述了预防和管理术后房颤的基本原则。
8.6.1 术后房颤的预防
术前使用β受体阻滞剂与术后房颤发生率降低相关204,665-667,但与死亡、卒中或AKI等主要不良事件无关。668重要的是,在一项大型随机对照试验中,围手术期美托洛尔与死亡率风险增加相关。185 在一项荟萃分析中,胺碘酮(口服或静脉注射)与β-受体阻滞剂在减少术后房颤方面同样有效,207 而联合应用的效果优于单独使用β-受体阻断剂。208较低累积剂量的胺碘酮(<3000 mg)可能有效,且不良事件较少。669–671其他干预措施的数据--如他汀类药物、672,673镁、674索他洛尔、666秋水仙碱、675或皮质类固醇676--的数据并不健全。
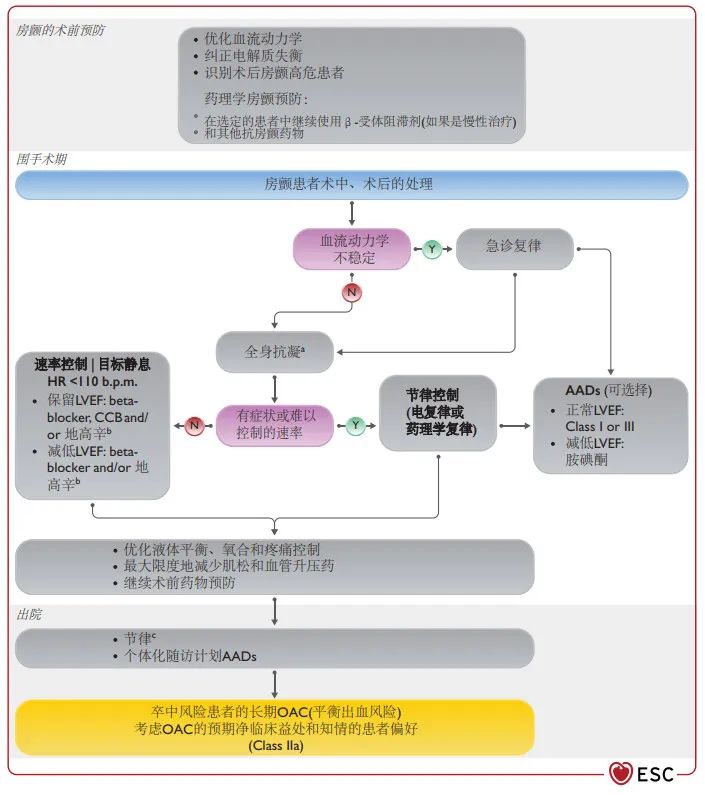
图20 术后房颤的预防和处理。AAD,抗心律失常药物;AF,房颤;b.pm,每分钟搏动;CCB,钙通道阻滞剂;HR,心率;LVEF,左心室射血分数。N,否;Y,是。a取决于CHA2DS2VASC评分,术后出血风险。b在手术后的急性期,除非血压升高,否则最好联合使用小剂量的β-受体阻滞剂和负荷地高辛以避免低血压。c应包括在3个月前进行心脏科就诊。改编自2020年ESC关于房颤诊断和处理的指南。99
8.6.2 术后房颤的处理
8.6.2.1 心率和/或节奏控制
在血流动力学不稳定的术后房颤患者中,紧急电刺激或可能的药物刺激(即静脉注射胺碘酮666或维纳卡兰679)进行心脏复律。99对于术后血流动力学稳定的房颤患者,在心律失常期间确保最佳的心室率控制是强制性的(例如,根据需要使用倍他受体阻滞剂或维拉帕米)。由于术后房颤通常是自我终止的,可能不需要非紧急复律。如果房颤持续≥48h,术后房颤的非急诊复律应遵循心包复律血栓预防的原则(即只有在TEE排除左房血栓或推迟3周治疗性房颤治疗后才能进行)。值得注意的是,一项针对心脏手术后房颤患者的RCT显示,与心率控制策略相比,节律(即实现并维持窦性心律)没有净临床优势。因此,血流动力学稳定的术后AF患者的心率或节律控制治疗决策应基于患者的症状和共同知情的治疗决策。99
8.6.2.2 心房颤动相关血栓栓塞症并发症的预防
对于所有术后房颤患者,应根据患者的卒中风险(CHA2DS2-VASc)和术后出血风险,考虑在住院期间尽早开始抗凝治疗。在一项大型荟萃分析中,与术后无房颤的患者相比,术后有房颤的患者早期卒中风险高62%,长期卒中风险高37%(术后房颤的长期卒中发生率为2.4%,无房颤的患者为0.4%),早期和长期死亡率分别高44%和37%。661重要的是,术后房颤与接受NCS的患者的长期卒中风险更相关(HR,2.00;心脏手术组(HR,1.2;95%CI,1.07-1.34;P<0.0001。)661
长期房颤治疗对预防术后房颤患者中风或系统性血栓的效果,其证据来自观察性研究。664,681-685在最近的一项研究中,NCS术后房颤与普通的非手术房颤的长期血栓栓塞性风险相似,并且在两组中使用OAC与血栓栓塞症的风险和全原因死亡率相似(CHA2DS2-VASC3.0+1.7)。686
根据现有证据,所有有中风风险的术后房颤患者都应考虑长期OAC。如果抗凝是非肠道启动的,建议大多数患者使用低分子肝素或磺达肝素(而不是普通肝素)。长期治疗应首选非维生素K拮抗剂口服抗凝,而不是VKA。可在3个月后重新评估OAC的延续情况。一项关于NCS患者术后发生房颤的最佳长期OAC使用的小型RCT(ASPIRE-AF;NCT03968393)正在进行中。
8.7 围手术期卒中
在NCS方面,报告了0.08-0.70%普通手术患者,0.2-0.9%需要骨科手术的患者,0.6-0.9%肺部手术,以及0.8-3.0%涉及周围血管的手术。687,688相关的死亡率从18%至26%。687,688一项对523,059名接受NCS的患者的最新分析报告显示,围术期中风的发生率较低(0.1%),尽管这种不良事件的发生与30天内围手术期死亡率增加8倍有关,与0.20%的绝对风险增加相对应。689围手术期卒中主要是缺血性或心源性血栓,而房颤往往是主要的潜在疾病。触发因素包括取消抗凝和与手术相关的高凝状态。其他病因包括起源于主动脉或主动脉上血管的动脉栓塞症,以及伴有颅内小血管疾病的局部动脉粥样硬化血栓。低灌注率--与围手术期动脉低血压和/或颈颅血管严重狭窄有关--是围手术期卒中的罕见原因。690罕见的是,围手术期卒中可能是由于空气、脂肪或反常栓塞。
为了减少围手术期卒中的风险,应尽可能在整个围手术期内继续进行抗血小板/抗凝治疗。或者,停药的时间应尽可能短,同时权衡血栓栓子和出血的风险(见第5.2节)。
充分选择麻醉技术(局部麻醉、神经麻醉和全身麻醉)、房颤的预防和治疗、正常血糖的控制(避免高血糖和低血糖)以及围手术期严密的血压控制都可能有助于降低围手术期中风的风险。
如果术后发生中风,必须立即采取行动:血管CT和神经科/神经外科会诊,目标是在急性血栓闭塞的情况下恢复血流。
推荐表34 围手术期心血管并发症的建议

第9章 关键信息
· NCS围手术期CV并发症的发生对预后有很大影响。
· 接受NCS治疗的患者CV并发症的风险由患者相关因素、手术类型和手术发生的情况(择期手术vs.急诊手术; 地方或三级医院)。
· 通过充分的术前风险评估和采取有效的风险降低策略,可以降低特定的患者相关风险。
· 将手术风险量化为低、中、高有助于确定哪些患者应从心血管并发症的预防、诊断和治疗策略中有最大获益。
· 正确选择手术类型和时机可以减少并发症的风险。
· 患者的价值观、生活质量和对手术获益和风险的偏好都要考虑在内,知情的患者也要参与治疗决策。风险应以相关术语告知患者。(例如1 / 100)。
· 临床检查、患者自述的做功能力和无创检查是术前心脏评估的基础。
· 应根据手术风险、诊断精确程度、医疗资源利用率和费用选择合适的心脏器械和功能检查。
· 针对需要择期行NCS的老年患者,围手术期评估应包括衰弱筛查,衰弱筛查已被证实是老年外科人群预后不良的一个极好的预测因素。
· 治疗已存在或新诊断的CV疾病(例如:冠状动脉及周围血管疾病、心律失常、心衰)应根据NCS术前风险,并结合相关指南的建议进行个体化治疗。
· NCS术前对伴随心脏疾病鼓励进行多学科方法评估治疗,可提高围手术期的安全性而不造成不必要的手术延迟。
· NCS患者围手术期有效的抗凝治疗可提供潜在的获益,预防血栓事件,而没有额外的出血并发症。
· 对于术前和术后阶段治疗药物的调整,通过简单的口头和书面说明与患者进行清晰、简明的沟通是很重要的。
· NCS围手术期的管理旨在避免血流动力学失衡,同时确保充分的心脏保护措施。
· 医疗工作者对接受中、高危NCS的高危患者围手术期CV并发症要有高度的警惕,并要监测PMI的发生。
· 通过特定指标对治疗质量进行常规评估对于记录和衡量NCS患者预防和治疗策略的成功与否非常重要。
第10章 有待更多证据支持
· NCS前能从风险分层评估中获益的个体年龄界值(被认为是心血管健康的)仍有待研究。
· 不同国家、性别之间NCS的结果差异仍需进一步的研究,以便提供个体化的围手术期管理、保障患者安全。
· 心脏生物标志物、手持超声、problem FOCUS和负荷超声心动图对既往未知的心脏杂音、呼吸困难、水肿和胸痛的NCS患者进行心脏风险分层的附加价值仍然缺乏证据。FOCUS对于紧急或时效性手术结果的影响需要进一步研究。
· 非缺血性心脏病患者NCS术前负荷影像学检查(超声心动图或MRI)对减少围术期CV并发症的影响有待进一步研究。
· 右心导管在接受NCS的晚期心衰患者或严重肺动脉高压患者中的作用尚不明确。
· 对与接受高危NCS的心脏高危病患者,以人工智能为基础的系统对即将发生的不良事件是否能及时监测和应对还有待进一步研究。
· NCS的患者围术期严重心律失常事件的病理生理学、原因和时间分布特点仍需要系统研究。
· 术前CIED程控时机的策略取决于设备类型、NCS类型和紧急情况,该策略以及NCS期间EMI风险仍有待于进一步明确以确保患者最大限度安全。
· 高危CCS患者(除外左主干或三支血管CAD,左室功能降低)在择期的高危NCS术前进行常规心肌血运重建的益处尚不明确。
· 关于机械瓣植入的患者抗凝桥接的必要性仍需更多的证据。
· 对于血栓事件高危的紧急或时效性NCS患者仍然缺乏术前最佳抗栓治疗策略的证据,包括:(i)使用体外血液灌流或NOAC拮抗剂(正在进行的试验NCTO4233073);(ii)使用白蛋白、体外血液灌流或PB2452特异性拮抗剂拮抗替格瑞洛(正在进行的PB2452的试验NCT04286438);和(iii) 中断P2Y12受体抑制剂(糖蛋白IIb/llla受体抑制剂或cangrelor)时过早停止或桥接。
· 目前还缺乏有力的证据来评估血小板功能检测在指导NCS患者抗血小板治疗策略中的作用。
· 关于NCS患者术后房颤抗凝的必要性和获益仍然缺乏证据(正在进行中ASPIRE-AF试验:NCT03968393)。
· NCS患者术后,除了维持β受体阻滞剂治疗外,其他减少术后房颤发生率的预防策略还有待进一步研究。
· 院内或院外发生PMI患者的最佳心脏检查和治疗方法还有待评估。
· 治疗围手术期低血压对术后结局的影响,HF新药物(SGLT2抑制剂和vericiguat)的使用,以及非甾体抗炎药(NSAIDs)作为术后急性疼痛的临时治疗等的影响需要进一步研究。
· 需要进行前瞻性研究来研究贫血算法和节约血液策略(使用节约血液的血管)的增加价值,以降低接受NCS的CV患者的贫血相关不良结果的风险。
第11章 性别差异
性别可能会显著影响有特定疾病的NCS患者的治疗和结果。合并症有性别依赖的临床表型和危险因素,这可能会影响围手术期发病率和死亡率。然而,拟行NCS患者性别、年龄和合并症之间相互作用仍缺乏相关的研究。
NCS术前评估可能会考虑性别因素,因为年龄矫正后的CVD发病率女性低于男性,因此,女性未被发现的疾病风险可能较低。然而,目前缺乏性别特异性评估策略的数据。
最近的报告显示,手术期间女性住院死亡率低于男性。41,691相比之下,在2009年至2016年期间609735例接受择期NCS的患者中,合并HF女性术后90天死亡率高于合并HF的男性。692需要进一步的研究来提供更多关于NCS男性和女性之间结局差异的资料。
一些研究报告称,女性出血的风险高于男性,但其他研究无法证实这一点。目前还没有试验系统地研究NCS患者抗栓治疗持续与中断的有效性和安全性的性别差异的影响。
育龄妇女贫血患病率高达30%(WHO全球贫血估计),693导致每年有数百万妇女在术前存在贫血的情况下接受手术。此外,由于女性的血容量和血红蛋白值低于男性,但面临着与男性相同的手术失血量,她们术后并发症的风险更高。此外,在择期手术中,女性的输血率和输血量高于男性。694因此,临床医生对于接受NCS的女性遵循患者血液管理计划是特别重要的。其他性别差异如生理、麻醉药物药代动力学和药效学上的性别差异可能会影响麻醉计划、疼痛管理、术后恢复和患者满意度。
在接受CIED植入的患者中,关于临床表现、电生理特点、并发症或长期预后的性别差异已有报道,695,696女性是AF患者卒中的众所周知的危险因素。697然而,没有具体的数据表明行NCS治疗的CIED或心律失常患者的危险因素或结局上的性别差异。
第12章 指南中“应该做”和“不应该做”的建议




AAA,腹主动脉瘤;AAD,抗心律失常药物;ACHD,成人先天性心脏病;ACS,急性冠脉综合征;AF,房颤;AR,主动脉返流;AS,主动脉瓣狭窄;AVR,主动脉瓣置换术;BMI,体重指数;BNP,B-型利钠肽;BMS金属裸支架;BSA,体表面积;CAD,冠心病;CCS,慢性冠脉综合征;CIED, 植入式心脏电子设备;CPET,心肺运动试验;CV,心血管;CVD,心血管病;DAPT,双联抗血小板;DES,药物洗脱支架;ECG,心电图;ESC,欧洲心脏病学会;GFR,肾小球滤过率;HbA1c,糖化血红蛋白;HF,心力衰竭;hs-cTn,高敏肌钙蛋白;ICA,有创冠脉造影;ICD, 植入心律转复除颤器;LMWH,低分子肝素;LV左室;LVEF,左室射血分数;LVESD,左室收缩末期内径;LVESDi,左室收缩末期内径指数;MHV,机械心脏瓣膜;MS,二尖瓣狭窄;NCS,非心脏手术;NOAC,非维生素K拮抗剂口服抗凝药NSAID,非甾体类抗炎药;NSTE-ACS,非 ST段抬高型心肌梗死;NT-proBNP, 氨基端B型利钠肽前体;OAC,口服抗凝剂;PAD,外周动脉疾病;PAH, 肺动脉高压;PCI, 经皮冠状动脉介入治疗;PE,肺栓塞;PMI, 围术期心肌梗死/损伤;PVC,室性早搏;RBC,红细胞;SAVR, 外科主动脉瓣置换术;SPAP, 收缩期肺动脉压;STEMI,ST-段抬高型心肌梗死;SVT, 室上性心动过速;TAVI, 经导管主动脉瓣植入术;TIA, 短暂性缺血发作;TTE, 经胸超声心动图;UFH,普通肝素;VAD, 心室辅助装置;VHD,心脏瓣膜病; 维生素K拮抗剂;VT,室性心动过速。
第13章 质控指标
质量指标(Qls)是可用于评估医疗质量的工具,包括医疗结构、过程和结果。698它们还可以作为一种机制,通过相关的质量改进并给医护人员提供一个基准,促进临床工作中遵循指南建议。699,700因此,Qls在提高医疗水平和改善CV结局方面的作用越来越被医疗主管部门、专家组、消费者和公众所认识。698
ESC认识到衡量和报告心血管疾病医疗质量和结果的必要性,并为心血管疾病医疗和结果量化标准制定了方法。698到目前为止,ESC已经为许多CV疾病701-703开发了Ql套件,并将其嵌入至ESC相关的临床实践指南(2020 ESC房颤诊断和管理指南;2021年ESC急慢性心力衰竭诊断和治疗指南;以及2021年ESC心脏起搏和心脏再同步化治疗指南)。99,412,481,704此外,ESC的目标是整合其Qls与临床注册,如欧洲观测研究计划(EORP)和心脏评估和随机试验(EuroHeart)欧洲统一注册705项目,提供关于整个欧洲CV疾病医疗模式和结果的“真实世界”数据。
在撰写本临床实践指南文件的同时,已经启动了一项流程,使用ESC方法学并通过与患者代表和领域专家的合作,为接受NCS的患者开发Qls。这些Qls可用于评估这组患者的医疗质量,并能捕捉到医疗提供的重要方面。Qls以及它们的测量规范和开发过程将在单独的论文中发表。
第14章 中心示意图
手术固有风险和患者相关围手术期CV并发症风险之间存在复杂的相互作用。后一种风险取决于计划接受NCS的患者的基线一般情况和CV状态。对于每个患者,手术风险的适当量化和沟通需要心内科医生、外科医生、麻醉师、全科医生和其他医疗保健提供者之间的密切合作(图21)。

图21中心示意图:手术固有风险和患者相关围手术期CV并发症风险之间复杂的相互作用